<!–

–>
(Αναδημοσίευση με μετάφραση από την μελέτη: “Cannabis, a complex plant: different compounds and different effects on individuals”, Zerrin Atakan, Ther Adv Psychopharmacol. 2012 Dec; 2(6): 241–254)
Περίληψη
“Η κάνναβη είναι ένα πολύπλοκο φυτό, με μείζονες ενώσεις όπως η δέλτα-9-τετραϋδροκανναβινόλη και η κανναβιδιόλη, που έχουν αντιτιθέμενες επιδράσεις. Η ανακάλυψη των ενώσεων της κάνναβης οδήγησε στην περαιτέρω ανακάλυψη ενός σημαντικού συστήματος νευροδιαβιβαστών που ονομάζεται ενδοκανναβινοειδές σύστημα. Αυτό το σύστημα διανέμεται ευρέως στον εγκέφαλο και στο σώμα και θεωρείται υπεύθυνο για πολλές σημαντικές λειτουργίες. Έχει υπάρξει μια πρόσφατη και συνεπής παγκόσμια αύξηση της δραστικότητας κάνναβης, με αυξανόμενες σχετικές ανησυχίες για την υγεία. Ορισμένες επιδημιολογικές ερευνητικές εργασίες έχουν δείξει σχέση μεταξύ της χρήσης που σχετίζεται με τη δόση κάνναβης και του αυξημένου κινδύνου εμφάνισης μιας διαρκούς ψυχωσικής ασθένειας. Ωστόσο, είναι επίσης γνωστό ότι δεν επηρεάζονται αρνητικά με τον ίδιο τρόπο όλοι όσοι χρησιμοποιούν κάνναβη. Αυτό που κάνει κάποιον πιο ευάλωτο στις αρνητικές της επιπτώσεις δεν είναι ακόμη γνωστό, ωστόσο υπάρχουν ορισμένοι αναδυόμενοι παράγοντες ευπάθειας, που κυμαίνονται από ορισμένα γονίδια μέχρι χαρακτηριστικά της προσωπικότητας. Σε αυτό το άρθρο παρουσιάζουμε πρώτα μια επισκόπηση της βιοχημικής βάσης της έρευνας σχετικά με την κάνναβη εξετάζοντας τις διάφορες επιδράσεις των δύο κύριων ενώσεων του φυτού και του ενδοκανναβινοειδούς συστήματος και στη συνέχεια εξετάζουμε τις διαθέσιμες πληροφορίες σχετικά με τους πιθανούς παράγοντες που εξηγούν τη μεταβολή των αποτελεσμάτων σε διαφορετικά άτομα”.
Λέξεις-κλειδιά: Cannabis (κάνναβη), delta-9-tetrahydrocannabinol (δέλτα-9-τετραϋδροκανναβινόλη), cannabidiol (κανναβιδιόλη), tetrahydrocannabivarin (τετραϋδροκανναβιβαρίνη), endocannabinoids (ενδοκανναβινοειδή), individual sensitivity to cannabis (ατομική ευαισθησία στην κάνναβη)
Εισαγωγή
Η κάνναβη είναι ένα σύνθετο φυτό με πάνω από 400 χημικές οντότητες εκ των οποίων περισσότερες από 60 είναι κανναβινοειδείς ενώσεις, μερικές από αυτές με αντίθετες επιδράσεις. Η κάνναβη είναι επίσης η πιο ευρέως χρησιμοποιούμενη παράνομη ουσία/φυτό στον κόσμο και η χρήση της έχει συνδεθεί με διάφορα προβλήματα ψυχικής υγείας, ιδιαίτερα στους νέους [Hall and Degenhardt, 2007, Degenhardt et al., 2010]. Παρά τις σχέσεις που συνδέουν μεταξύ της χρήσης και της ανάπτυξης προβλημάτων ψυχικής υγείας, είναι επίσης γνωστό ότι δεν επηρεάζεται το ίδιο ο καθένας που την χρησιμοποιεί. Σε αυτό το άρθρο θα παρουσιάσουμε μια επισκόπηση των διαφορετικών επιδράσεων των δύο κύριων ενώσεων του φυτού, καθώς και των επιπτώσεών τους σε διαφορετικά τμήματα του πληθυσμού. Πριν από την παρουσίαση των διαθέσιμων στοιχείων στη βιβλιογραφία σχετικά με τους λόγους των ποικίλων επιδράσεων της κάνναβης σε διαφορετικά άτομα, θα εξετάσουμε πρώτα τις τρέχουσες γνώσεις σχετικά με τη βιοχημεία του φυτού της κάνναβης και του ενδοκανναβινοειδούς συστήματος.
Σύντομο ιστορικό της βιοχημείας του φυτού της κάνναβης
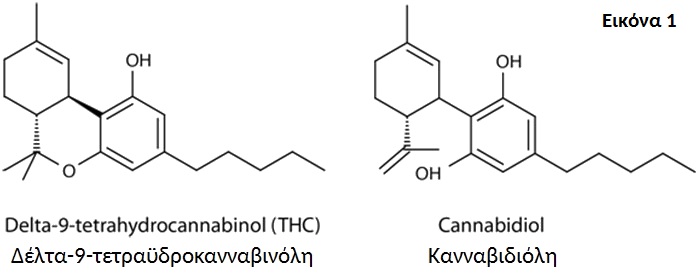
Παρόλο που η κάνναβη έχει χρησιμοποιηθεί και καλλιεργηθεί από την ανθρωπότητα για τουλάχιστον 6.000 χρόνια [Li, 1973], οι τρέχουσες γνώσεις μας σχετικά με τις φαρμακολογικές ιδιότητές της βασίζονται σε μελέτες που έγιναν μόνο στο τέλος του δέκατου ένατου αιώνα. Η πρώτη ένωση που απομονώθηκε σε καθαρή μορφή από το φυτό ήταν η κανναβινόλη (CBN) [Wood, 1899]. Αρχικά θεωρήθηκε λανθασμένα ότι είναι η κύρια δραστική ουσία του φυτού που είναι υπεύθυνη για τα ψυχοδραστικά αποτελέσματά του [Mechoulam and Hanus, 2000]. Η δεύτερη ένωση που βρέθηκε ήταν η κανναβιδιόλη (CBD) από τους Mechoulam και Shvo [Mechoulam and Shvo, 1963]. Τον επόμενο χρόνο το 1964, οι Gaoni και Mechoulam απομόνωσαν την κύρια δραστική ένωση, την δέλτα-9-τετραϋδροκανναβινόλη (d-9-THC) (Εικόνα 1) [Gaoni and Mechoulam, 1964].
Εικόνα 1. Χημικές δομές της δέλτα-9-τετραϋδροκανναβινόλης και της κανναβιδιόλης.
Σύστημα υποδοχέα κανναβινοειδών
Ένας άλλος ακρογωνιαίος λίθος στην έρευνα των κανναβινοειδών ήταν η ταυτοποίηση των ειδικών θέσεων πρόσδεσης της d-9-THC στον εγκέφαλο [Devane et al., 1988], ο οποίος ακολουθήθηκε από την κλωνοποίηση του υποδοχέα κανναβινοειδούς (CB1R) [Matsuda et al., 1990]. Αυτό το σύστημα ονομάστηκε “σύστημα υποδοχέα κανναβινοειδούς” (cannabinoid receptor system) λόγω της συγγένειας πρόσδεσης του με την d-9-THC σε αυτούς τους υποδοχείς ως μερικού αγωνιστή. Λίγο μετά, ανακαλύφθηκε ένας δεύτερος υποδοχέας, ο CB2R, [Munro et al., 1993]. Περίπου την ίδια χρονική στιγμή, η ύπαρξη του ενδοκανναβινοειδούς συστήματος επιβεβαιώθηκε από τους Devane και συνεργάτες μετά την εκχύλιση ενός μορίου, μιας αιθανολαμίνης του αραχιδονικού οξέος (ΑΕΑ), που δεσμεύτηκε σε αυτούς τους υποδοχείς [Devane et al., 1992]. Αυτός ο ενδοκανναβιοειδής αγωνιστής έλαβε την ονομασία “ανανδαμίδιο”, με βάση μια σανσκριτική λέξη που σημαίνει “ευδαιμονία”. Ο Mechoulam και οι συνάδελφοί του απομόνωσαν τον δεύτερο νευροδιαβιβαστή ενδοκανναβινοειδούς, την 2-αραχιδονυλγλυκερόλη (2-AG), 3 χρόνια αργότερα [Mechoulam et al., 1995]. Η έρευνα σε πιο πρόσφατα χρόνια έχει δείξει ότι η d-9-THC, ως μερικός συναγωνιστής, μοιάζει με το ανανδαμίδιο στη χημική συγγένειά του με τον CB1, αν και με λιγότερη αποτελεσματικότητα από το ανανδαμίδιο, ενώ εμφανίζει ακόμα χαμηλότερη αποτελεσματικότητα στους CB2Rs από ότι στους CB1Rs in vitro [Pertwee, 2008].
Οι υποδοχείς κανναβινοειδών 1 και 2
Οι CB1Rs είναι κυρίως στον εγκέφαλο, ιδιαίτερα στην ουσία nigra, τα βασικά γάγγλια, το μεταιχμιακό σύστημα, τον ιππόκαμπο και την παρεγκεφαλίδα, αλλά εκφράζονται επίσης στο περιφερικό νευρικό σύστημα, το ήπαρ, τον θυρεοειδή, τη μήτρα, τα οστά και τους όρχεις [Russo and Guy, 2006, Pagotto et al., 2006, Pertwee, 2006]. Οι CB2Rs εκφράζονται ως επί το πλείστον σε ανοσοκύτταρα, σπλήνα και στο γαστρεντερικό σύστημα και σε κάποιο βαθμό στον εγκέφαλο και στο περιφερικό νευρικό σύστημα [Izzo, 2004, Pertwee, 2006]. Είναι ενδιαφέρον ότι και οι CB1Rs και οι CB2Rs βρίσκονται επίσης στον ανθρώπινο πλακούντα και έχουν αποδειχθεί ότι παίζουν ρόλο στη ρύθμιση της δραστηριότητας μεταφορέων σεροτονίνης [Kenney et al., 1999]. Πράγματι, περαιτέρω έρευνες αποκάλυψαν ότι το ενδοκανναβινοειδές σύστημα παίζει επίσης σημαντικό ρόλο σε διάφορες πτυχές της ανθρώπινης αναπαραγωγής [Taylor et al., 2010].
Στον εγκέφαλο, οι CB1Rs βρίσκονται στα τερματικά των κεντρικών και περιφερειακών νευρώνων, όπου κυρίως προκαλούν ανασταλτική δράση στην συνεχή απελευθέρωση ενός αριθμού διεγερτικών και ανασταλτικών ντοπαμινεργικών νευροδιαβιβαστών γ-αμινοβουτυρικού οξέος (gamma-aminobutyric acid, GABA), γλουταμινεργικού, σεροτονινεργικού, νοραδρεναλίνης και ακετυλοχολίνης συστήματα νευροδιαβιβαστών (Εικόνα 2). Λόγω της εμπλοκής αυτών των συστημάτων επηρεάζουν λειτουργίες όπως η γνώση, η μνήμη, η κίνηση και η αντίληψη του πόνου [Howlett et al., 2002]. Η απελευθέρωση των ενδοκανναβινοειδών, όπως τα ΑΕΑ και 2-AG, από τις μετασυναπτικές θέσεις έως τη συναπτική σχισμή συμβαίνουν σε απόκριση στην αύξηση του ενδοκυτταρικού ασβεστίου και στη συνέχεια δρουν ως ανάδρομοι νευροδιαβιβαστές σε προσυναπτικά τοποθετημένα CB1Rs για να διατηρήσουν την ομοιόσταση και να αποτρέψουν την υπερβολική νευρωνική δραστηριότητα [Howlett et al., 2002, Terry et al., 2009]. Ακολούθως απομακρύνονται ταχέως από τον εξωκυτταρικό χώρο με μεταφορείς κανναβινοειδών, οι οποίοι συχνά αναφέρονται ως μεταφορείς μεμβράνης ανανδαμιδίου, οι οποίοι διευκολύνουν τη διάσπασή τους εσωτερικοποιώντας το μόριο και επιτρέποντας την πρόσβαση σε υδρολάση αμιδίου λιπαρού οξέος (fatty acid amide hydrolase) [Pertwee, 2010]. Παρά τη σημασία τους στο ενδοκαννοβινοειδές σύστημα, λίγα είναι γνωστά για τους μεταφορείς κανναβινοειδών.
Όταν χρησιμοποιείται κάνναβη, η d-9-THC ως μερικός συναγωνιστής δεσμεύεται με τους CB1Rs και δρα με λιγότερο επιλεκτικό τρόπο στην αναστολή της απελευθέρωσης νευροδιαβιβαστών που κανονικά ρυθμίζονται από τα ενδοκανναβινοειδή όπως τα AEA και 2-AG. Έχει υποτεθεί ότι μπορεί επίσης να αυξήσει την απελευθέρωση ντοπαμίνης, γλουταμικού και ακετυλοχολίνης σε ορισμένες περιοχές του εγκεφάλου, πιθανώς με αναστολή της απελευθέρωσης ανασταλτικού νευροδιαβιβαστή όπως GABA σε νευρώνες που απελευθερώνουν ντοπαμίνη, γλουταμικό ή ακετυλοχολίνη [Bhattacharyya et al., 2009α] (Εικόνα 2).
Εικόνα 2. Οι υποδοχείς CB1 – αποτελέσματα ενδοκανναβινοειδών και d-9-THC
Η απελευθέρωση του ανανδαμιδίου (AEA) και της 2-αραχιδονυλογλυκερόλης (2-AG) για την αναστολή του γλουταμινικού (Glu), του Gamma-αμινοβουτυρικού οξέος (GABA), της ακετυλοχολίνης (ΝΑ) και σεροτονίνης (5-ΗΤ). Τα ενδοκανναβινοειδή απομακρύνονται από τον εξωκυτταρικό χώρο από τους κανναβινοειδείς μεταφορείς.

Ωστόσο, οι λειτουργίες των CB1Rs δεν είναι πάντα απλές λόγω των σύνθετων αλληλεπιδράσεων με τα άλλα συστήματα νευροδιαβιβαστών. Αυτά σχετίζονται με τους CB1Rs και τους CB2Rs που είναι μέλη της υπερ-οικογένειας υποδοχέων συζευγμένων με πρωτεΐνη G (GPCRs) [Pertwee et al., 2010]. Οι GPCRs αισθάνονται ένα εξωτερικό μόριο έξω από το νευρικό κύτταρο και με επαφή με το μόριο μπορούν να σηματοδοτούν οδούς μεταγωγής, οι οποίες τελικά οδηγούν σε κυτταρικές αποκρίσεις. Εξωτερικοί συνδετήρες όπως η d-9-THC, διάφορες συνθετικές ενώσεις και ενδοκανναβινοειδή όπως το ανανδαμίδιο μπορούν να ενεργοποιήσουν αυτούς τους υποδοχείς [Pertwee et al., 2010]. Είναι ενδιαφέρον ότι μερικά αλκυλαμίδια από το φυτό Echinacea μπορούν επίσης να προσδεθούν στους CB2Rs ακόμη πιο έντονα από ότι τα ενδογενή κανναβινοειδή [Raduner et al., 2006]. Ο μηχανισμός δράσης για τη CBD δεν είναι ακόμη σαφής, καθώς αυτή η ένωση δεν δεσμεύεται με τους CB1Rs ή τους CB2Rs [Tsou et al., 1998, Hayakawa et al., 2008].
Κανονικά οι GPCRs συνδέονται μαζί για να σχηματίσουν ένα σύμπλεγμα υποδοχέα. Εντούτοις, οι επιδράσεις σηματοδότησης μπορεί να είναι πολύπλοκες εξαιτίας του σχηματισμού ετερομερών CB1Rs, οι οποία μπορούν να οριστούν ως έχοντες διαφορετικά μέρη όπως υπο-μονάδες, με δύο ή περισσότερους άλλους GPCRs, ιδιαίτερα αν αυτοί εκφράζονται πυκνά στον ίδιο νευρώνα. Για παράδειγμα, ένας CB1R μπορεί να σχηματίσει ένα ετερομερές με υποδοχέα D2 της ντοπαμίνης ή σε άλλη περίπτωση μπορεί επίσης να σχηματίσει ένα ετερομερές με δύο άλλους υποδοχείς όπως ντοπαμίνη D2 και αδενοσίνη Α2Α [Navarro et al., 2008]. Κατά τρόπο ενδιαφέροντα, ως αποτέλεσμα, οι δεσμεύσεις συνδέτη μπορούν να προκαλέσουν μη αναμενόμενες φαρμακολογικές επιδράσεις. Για παράδειγμα, σε ένα σύμπλοκο ετερομερούς, όχι μόνο ο ανταγωνιστής του CB1R αλλά και ο άλλος ανταγωνιστής του υποδοχέα μπορεί να εμποδίσει την ανασταλτική επίδραση του αγωνιστή CB1R. Αυτό έχει καταδειχθεί από τους Marcellino και συνεργάτες όταν ο ανταγωνιστής CB1R rimonabant και ο συγκεκριμένος ανταγωνιστής Α2ΑΚ MSX-3 παρεμπόδισαν την ανασταλτική επίδραση του αγωνιστή CB1 επί της επαγόμενης από D2 τύπου αγωνιστή υπερκινητικότητας σε αρουραίους [Marcellino et al., 2008]. Τα ετερομερή υποδοχέα παρέχουν καλύτερη κατανόηση του τρόπου με τον οποίο αυτά τα διαφορετικά συστήματα νευροδιαβιβαστών αλληλεπιδρούν μεταξύ τους. Υπάρχουν επίσης αναμφισβήτητα αποδεικτικά στοιχεία για την ύπαρξη ετερομερών CB1R σε δενδριτικές στήλες των GABAεργικών εγκεφαλινεργικών νευρώνων, ιδιαίτερα σε μετασυναπτική θέση [Ferré et al., 2009]. Οι συγγραφείς προτείνουν ότι είναι πιθανό ότι λειτουργικά ετερομερή υποδοχέα CB1-A2A-D2 μπορούν να βρεθούν στις δενδριτικές στήλες των GABAεργικών εγκεφαλινεργικών νευρώνων, όπου αυτά εκφράζονται σε μεγάλο βαθμό, και η ανάλυσή τους παρέχει νέες πληροφορίες σχετικά με το ρόλο των ενδοκανναβινοειδών στη λειτουργία του ραβδωτού και μπορούν να θεωρηθούν ως οπισθοδρομικά σήματα που αναστέλλουν την απελευθέρωση νευροδιαβιβαστών. Περαιτέρω στοιχεία για την ύπαρξη D2 και CB1Rs στο κοιλιακό ραβδωτό παρέχονται με ανάλυση ηλεκτρονικού μικροσκοπίου, η οποία επιβεβαιώνει τη συνάφεια με την ανταμοιβή και την ευφορικότητα, καθώς και τα κινητικά αποτελέσματα που παράγονται από την κάνναβη, ενισχύοντας τα επίπεδα ντοπαμίνης, ιδιαίτερα στον nucleus accumbens [Pickel et al., 2006]. Η έκφραση CB1Rs στο ραβδωτό και ο ρόλος τους στη διαφορική σηματοδότηση μεταξύ διαφορετικών αναπτυξιακών σταδίων και αισθητικοκινητικών και συσσωματικών / περιοριστικών κυκλωμάτων έχουν επίσης καταδειχθεί σε μια πρόσφατη μελέτη [van Waes et al., 2012].
Πιο πρόσφατα έχει αποδειχθεί ότι οι CB2Rs σχηματίζουν ετερομερή με τους CB1Rs στον εγκέφαλο και συν-ενεργοποιούν αγωνιστικά τους CB1Rs και CB2Rs κάτι που έχει ως αποτέλεσμα σε αρνητική διασταύρωση στην φωσφορυλίωση AKT1 και στην ανάπτυξη νευριτών [Callén et al., 2012]. Οι συγγραφείς επισημαίνουν ότι υπάρχει ένας αμφίδρομος διασταυρούμενος ανταγωνισμός ο οποίος εμπλέκει τους ανταγωνιστές του κάθε υποδοχέα, ο ένας να μπλοκάρει τον άλλο. Προτείνεται ότι αυτά τα δεδομένα φωτίζουν τον μηχανισμό με τον οποίο οι CB2Rs μπορούν να τροποποιήσουν αρνητικά τη λειτουργία των CB1Rs.
Τα τελευταία χρόνια έχουν ανακαλυφθεί τρεις άλλοι υποψήφιοι νέοι υποδοχείς, οι GPR18, GPR19 και GPR55, καθώς και οι μη CB1R και οι μη CB2R, αλλά η γνώση σχετικά με τα συστήματα αυτά είναι ελλιπής και η συζήτηση σχετικά με το κατά πόσον πληρούν τα κριτήρια για να χαρακτηριστούν ως δέκτες ή κανάλια είναι σε εξέλιξη [Mackie and Stella, 2006, Pertwee et al., 2010, Pamplona and Takahashi, 2012]. Γενικά διαπιστώνεται ότι ορισμένα ενδοκανναβινοειδή, η d-9-THC και αρκετοί συνθετικοί αγωνιστές και ανταγωνιστές CB1R/CB2R μπορούν επίσης να αλληλεπιδράσουν με έναν αριθμό μη-CB1, μη-CB2 GPCRs, διαύλους ιόντων με συνδετικό μόριο και πυρηνικούς υποδοχείς (βλ. αξιολόγηση από τους Pertwee και συνεργάτες [Pertwee et al., 2010]). Συμπερασματικά, οι βιοχημικοί μηχανισμοί αυτού του συστήματος είναι πολύ πιο πολύπλοκοι και η συζήτηση σχετικά με το κατά πόσο οποιοδήποτε γνωστό κανάλι θηλαστικού ή μη CB1R/CB2R πρέπει να ταξινομηθεί ως ένας νέος υποδοχέας ή κανάλι κανναβινοειδούς “CB3” είναι σε εξέλιξη.
Η συμμετοχή των συγκεκριμένων νευρικών περιοχών και των συστημάτων νευροδιαβιβαστών εδώ είναι σημαντική λόγω του γεγονότος ότι οι ίδιες περιοχές εγκεφάλου και τα συστήματα νευροδιαβιβαστών εμπλέκονται επίσης σε ψυχώσεις, ιδιαίτερα στη σχιζοφρένεια [van Os and Kapur, 2009, Smieskova et al., 2010, Stone, 2011].
Λειτουργίες του ενδοκανναβινοειδούς συστήματος υποδοχέα
Τα διαθέσιμα στοιχεία δείχνουν ότι δεν έχουμε ακόμη πλήρη κατανόηση των ποικίλων λειτουργιών του ενδοκανναβινοειδούς συστήματος, το οποίο κατανέμεται ευρέως τόσο στον εγκέφαλο όσο και στο περιφερικό σύστημα και στους περισσότερους αδένες και όργανα στο σώμα. Ωστόσο, έχει σημειωθεί δραματική αύξηση της έρευνας που διερευνά το σύστημα αυτό κατά την τελευταία δεκαετία και θεωρείται ότι είναι ένας από τους ταχύτερα αναπτυσσόμενους τομείς της ψυχοφαρμακολογίας, ενώ ο αριθμός των “κλασικών” μελετών για νευροδιαβιβαστές είτε μειώθηκε είτε παρέμεινε ο ίδιος [Pamplona and Takahashi, 2012]. Παρόλο που οι γνώσεις μας σχετικά με το ρόλο του ενδοκανναβινοειδούς συστήματος εξελίσσονται ακόμα, τα διαθέσιμα στοιχεία δείχνουν ότι αυτό το σύστημα έχει πολλαπλούς ρυθμιστικούς ρόλους σε νευρωνικά, αγγειακά, μεταβολικά, ανοσολογικά και αναπαραγωγικά συστήματα. Όπως αναφέρθηκε προηγουμένως, ο ρυθμιστικός ρόλος κατά παραγγελία σε άλλα συστήματα νευροδιαβιβαστών επηρεάζει σαφώς λειτουργίες όπως η γνώση, η μνήμη, η κίνηση και η αντίληψη του πόνου [Howlett et al., 2002].
Το φυτό της κάνναβης
Το φυτό της κάνναβης έχει δύο βασικά υπο-είδη, την Cannabis indica και την Cannabis sativa και μπορούν να διαφοροποιηθούν ανάλογα με τα διαφορετικά φυσικά χαρακτηριστικά τους. Οι ποικιλίες με κυρίαρχο το υπο-είδος indica είναι μικρά φυτά με ευρεία, σκούρα πράσινα φύλλα και έχουν υψηλότερη περιεκτικότητα σε κανναβιδιόλη από τα φυτά sativa στα οποία το περιεχόμενο της THC είναι υψηλότερο. Οι ποικιλίες με κυρίαρχο το υπο-είδος sativa είναι συνήθως ψηλότερες και έχουν λεπτά φύλλα με ανοιχτό πράσινο χρώμα. Λόγω του υψηλότερου περιεχομένου THC, η C. sativa είναι η προτιμώμενη επιλογή από τους χρήστες. Πρόκειται για ένα σύνθετο φυτό με περίπου 426 χημικές οντότητες, εκ των οποίων πάνω από 60 είναι κανναβινοειδείς ενώσεις [Dewey, 1986]. Οι τέσσερις κύριες ενώσεις είναι, η d-9-THC, η CBD, η d-8-THC και η CBN (κανναβινόλη), οι οποίες έχουν ερευνηθεί περισσότερο [Pertwee, 1997, 2008, Pamplona and Takahashi, 2012].
Στο φυτό, τα κανναβινοειδή συντίθενται και συσσωρεύονται ως κανναβινοειδή οξέα, αλλά όταν το φυτικό προϊόν ξηραίνεται, φυλάσσεται και θερμαίνεται, τα οξέα αποκαρβοξυλιώνονται σταδιακά στις κατάλληλες μορφές τους, όπως σε CBD ή σε d-9-THC [De Meijer et al., 2003]. Αρχικά θεωρήθηκε ότι η CBD ήταν ο μεταβολικός γονέας της d-9-THC, αλλά αργότερα διαπιστώθηκε ότι η βιοσύνθεση του συμβαίνει σύμφωνα με μια γενετικά καθορισμένη αναλογία [Russo and Guy, 2006]. Αν και οι χημικές δομές και των τεσσάρων ενώσεων είναι παρόμοιες, τα φαρμακολογικά τους αποτελέσματα μπορεί να είναι πολύ διαφορετικά. Οι πλέον ερευνηθείσες ενώσεις του φυτού είναι η d-9-THC και η CBD και ως εκ τούτου θα επικεντρωθούμε κυρίως σε αυτές τις δύο ενώσεις και τις διαφορές τους.
Δέλτα-9-τετραϋδροκανναβινόλη και κανναβιδιόλη
Οι φυσικές ενώσεις του φυτού της κάνναβης αναφέρονται επίσης ως φυτοκανναβινοειδή από τα οποία η d-9-THC είναι το κύριο ψυχοδραστικό συστατικό και έχει διερευνηθεί ευρέως τόσο σε ζώα όσο και σε ανθρώπους. Χαρακτηριστικά παράγει, με δοσοεξαρτώμενο τρόπο, υπο-ενεργότητα, υποθερμία, χωρική και λεκτική βραχυπρόθεσμη μνήμη [Hayakawa et al., 2007]. Ωστόσο, η δεύτερη κύρια ένωση, η CBD, δεν επηρεάζει την κινητική δραστηριότητα, τη θερμοκρασία του σώματος ή τη μνήμη από μόνη της. Ωστόσο, υψηλότερες δόσεις CBD μπορούν να ενισχύσουν τις χαμηλότερες δόσεις της d-9-THC ενισχύοντας το επίπεδο έκφρασης CB1R στον ιππόκαμπο και τον υποθάλαμο. Οι συγγραφείς υποδεικνύουν ότι η CBD ενισχύει τις φαρμακολογικές επιδράσεις της d-9-THC μέσω ενός εξαρτώμενου από CB1R μηχανισμού [Hayakawa et al., 2007].
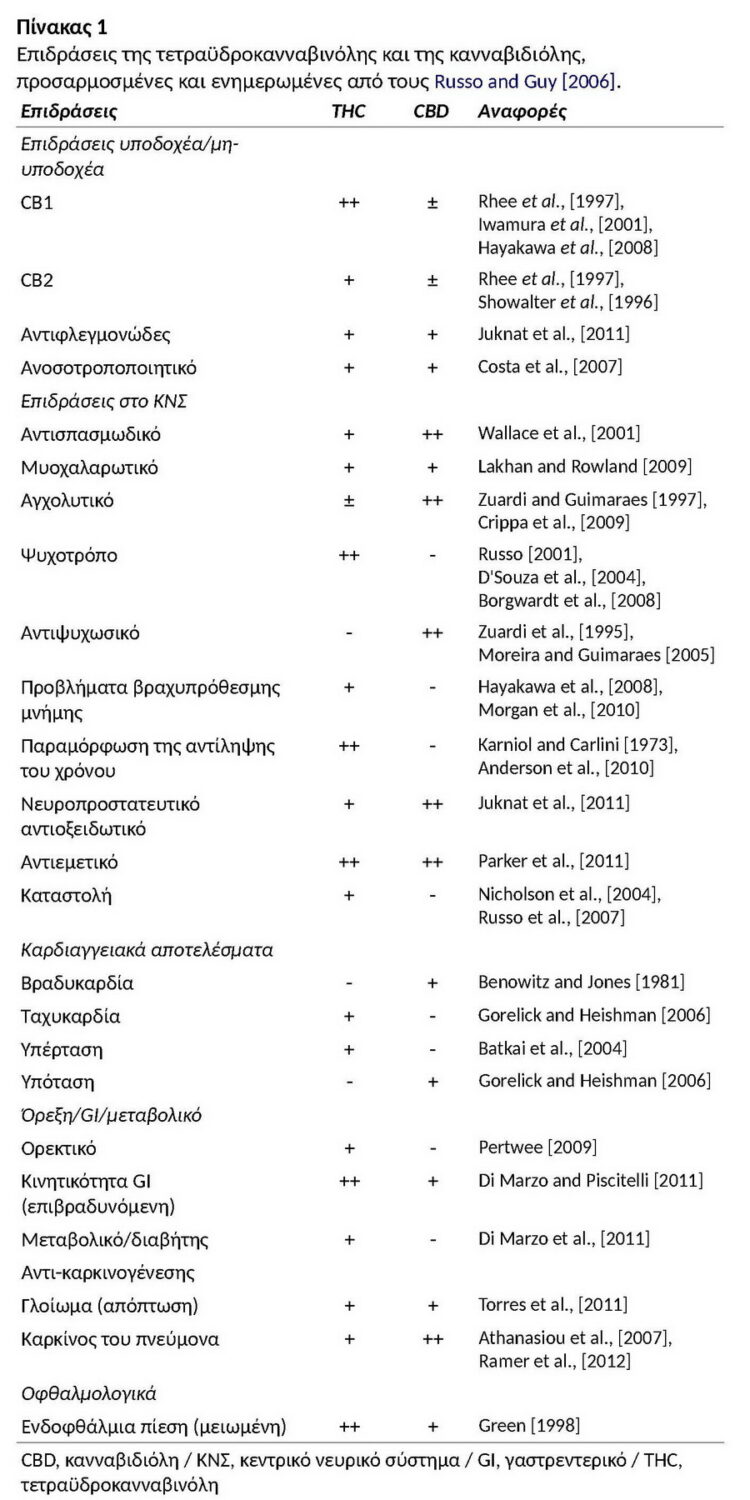
Η διαθέσιμη έρευνα δείχνει ότι οι κύριες δύο ενώσεις, η d-9-THC και η CBD, παρόλο που έχουν παρόμοιες επιδράσεις σε ορισμένους τομείς, έχουν επίσης σχεδόν αντίθετες επιδράσεις μεταξύ τους σε άλλες απόψεις [Carlini et al., 1974, Borgwardt et al., 2008, Fusar-Poli et al., 2009, Morrison et al., 2009, Bhattacharyya et al., 2009b, Winton-Brown et al., 2011]. Ο Πίνακας 1 συνοψίζει τις ποικίλες επιδράσεις αυτών των δύο ενώσεων.
Στην πραγματικότητα, οι διαφορετικές και αντίθετες επιδράσεις των κυριότερων δύο ενώσεων του φυτού παρατηρήθηκαν σε μερικές πρώιμες μελέτες. Σε μια διπλή-τυφλή μελέτη με 40 υγιείς εθελοντές, οι Karniol και συνεργάτες χορήγησαν από του στόματος d-9-THC και CBD και τα μείγματα των δύο μαζί, ενώ μετρήθηκαν τα ποσοστά παλμού, οι χρόνοι παραγωγής και οι ψυχολογικές αντιδράσεις [Karniol et al. 1974]. Ενώ η d-9-THC μόνο αύξησε τον ρυθμό των παλμών, διαταραγμένα καθήκοντα χρόνου και προκάλεσε ισχυρές ψυχολογικές αντιδράσεις στα υποκείμενα, η CBD μόνο της δεν προκάλεσε τέτοια αποτελέσματα. Ωστόσο, η CBD ήταν αποτελεσματική στην παρεμπόδιση των περισσότερων αποτελεσμάτων της d-9-THC όταν χορηγήθηκαν και οι δύο ουσίες. Η CBD μείωσε επίσης την συνιστώσα άγχους των επιδράσεων της d-9-THC με τέτοιο τρόπο ώστε τα άτομα να αναφέρουν πιο ευχάριστα αποτελέσματα.
Πιο πρόσφατα, έχουν πραγματοποιηθεί αρκετές μελέτες πρόκλησης φαρμάκων με υγιείς μεθοδολογίες που εξετάζουν τις επιδράσεις και των δύο αυτών ενώσεων. Η ομάδα μας πραγματοποίησε μια σειρά διπλών-τυφλών, ψευδο-τυχαίων μελετών σε υγιείς εθελοντές που είχαν προηγούμενη ελάχιστη έκθεση στην κάνναβη. Όλοι οι συμμετέχοντες έλαβαν 10 mg d-9-THC, 600 mg CBD και εικονικό φάρμακο (αλεύρι) σε τρεις διαφορετικές συνεδρίες απεικόνισης με λειτουργικό μαγνητικό συντονισμό, ενώ εκτελούσαν μια εργασία αναστολής απόκρισης, μια λεκτική εργασία μνήμης, ένα συναισθηματικό έργο και ένα ακουστικό και οπτικό αισθητήριο καθήκον επεξεργασίας. Τα συνολικά συμπερασματικά αποτελέσματα έδειξαν ότι οι d-9-THC και CBD είχαν διαφορετικές συμπεριφορικές επιδράσεις και επίσης, κατά περιόδους, αντίθετη ενεργοποίηση του εγκεφάλου σε διάφορες περιοχές [Borgwardt et al., 2008, Fusar-Poli et al., 2009, Bhattacharyya et al., 2009b, Winton-Brown et al., 2011]. Η d-9-THC προκάλεσε παροδικά ψυχωτικά συμπτώματα και αύξησε τα επίπεδα άγχους, τοξίκωσης και καταστολής, ενώ η CBD δεν είχε σημαντική επίδραση στη συμπεριφορά ή σε αυτές τις παραμέτρους.
Σε σχέση με τα δεδομένα απεικόνισης, κατά τη διάρκεια της εργασίας αναστολής απόκρισης, σε σχέση με το εικονικό φάρμακο, η d-9-THC εξασθένησε τη δέσμευση των περιοχών του εγκεφάλου που κανονικά προκαλούν αναστολή απόκρισης, ενώ η CBD διαμόρφωσε δραστικότητα σε περιοχές που δεν εμπλέκονται με αυτή την εργασία [Borgwardt et al., 2008]. Κατά τη διάρκεια της λεκτικής εκμάθησης και ανάκτησης των καθηκόντων ζεύγους λέξεων, η d-9-THC διαμόρφωσε δραστηριότητα σε μεσοχρονικές και κοιλιακές περιοχές, ενώ η CBD δεν είχε τέτοια επίδραση [Bhattacharyya et al., 2009b]. Κατά τη διάρκεια μιας συναισθηματικής εργασίας, η d-9-THC και η CBD είχαν σαφώς διακριτές επιδράσεις στη νευρική, ηλεκτρο-δερμική και συμπτωματική απόκριση σε πρόσωπα φόβου [Fusar-Poli et al., 2009]. Τα αποτελέσματά μας υποδεικνύουν ότι οι επιδράσεις της CBD στην ενεργοποίηση σε μεταιχμιακές και παρα-μεταιχμιακές περιοχές μπορεί να συμβάλλουν στην ικανότητά της να μειώνει την αυτόνομη διέγερση και το υποκειμενικό άγχος, ενώ οι αγχογόνες επιδράσεις της d-9-THC μπορεί να σχετίζονται με επιδράσεις σε άλλες περιοχές του εγκεφάλου. Κατά τη διάρκεια της ακουστικής εργασίας, και πάλι αυτές οι δύο ενώσεις είχαν αντίθετες επιδράσεις στον ανώτερο χρονικό φλοιό όταν τα άτομα άκουσαν ομιλία και στον ινιακό φλοιό κατά τη διάρκεια της οπτικής επεξεργασίας [Winton-Brown et al., 2011].
Η ομάδα μας αξιολόγησε επίσης το κατά πόσον η προ-επεξεργασία με CBD θα μπορούσε να αποτρέψει τα οξεία ψυχωτικά συμπτώματα που προκλήθηκαν από την d-9-THC όταν έξι υγιείς εθελοντές έλαβαν d-9-THC ενδοφλεβίως σε δύο περιπτώσεις μετά από εικονικό φάρμακο ή προ-επεξεργασία CBD [Bhattacharyya et al., 2010]. Διαπιστώσαμε ότι η προ-επεξεργασία με CBD απέτρεψε τα παροδικά ψυχωτικά συμπτώματα που προκλήθηκαν από την d-9-THC.
Τόσο μελέτες σε ζώα όσο και σε ανθρώπους δείχνουν ότι η CBD έχει αγχολυτικές ιδιότητες. Στην πραγματικότητα σε μια πρόσφατη διπλή-τυφλή μελέτη που διεξήχθη σε ασθενείς με γενικευμένη διαταραχή κοινωνικού άγχους, διαπιστώθηκε ότι σε σχέση με το εικονικό φάρμακο, η CBD μείωσε σημαντικά το υποκειμενικό άγχος και η επίδρασή της σχετίζεται με τη δράση της σε μεταιχμιακές και παρα-μεταιχμιακές περιοχές, όπως καταδείχτηκε με μονής εκπομπής πρωτονίων υπολογιστική τομογραφία [Crippa et al., 2011].
Η CBD έχει επίσης προταθεί να έχει αντιψυχωσικά αποτελέσματα και θεωρείται πιθανό αντιψυχωτικό φάρμακο, ιδιαίτερα λόγω του σχετικά χαμηλού προφίλ παρενέργειας [Zuardi et al., 1995]. Επιπλέον, αναπτύσσεται επίσης ως ένα πιθανό “φάρμακο” για διάφορες άλλες καταστάσεις, όπως η φλεγμονή, ο διαβήτης, ο καρκίνος και οι νευροεκφυλιστικές ασθένειες [Izzo et al., 2009].
Η CBD δεν είναι η μόνη ένωση που παρουσιάζει διαφορετικές επιδράσεις στο κύριο συστατικό της κάνναβης, την d-9-THC, έναν μερικό αγωνιστή CB1R. Μια άλλη ενδιαφέρουσα ένωση του φυτού, η d-9-τετραϋδροκανναβιβαρίνη (d-9-THCV), ένας νέος ανταγωνιστής CB1R, επίσης ασκεί δυνητικά χρήσιμες δράσεις στη θεραπεία της επιληψίας και της παχυσαρκίας [Pertwee, 2008, Izzo et al., 2009]. Μια ανασκόπηση αυτής της ένωσης, μαζί με τις d-9-THC και CBD από Pertwee, υποδηλώνει ότι οι φυτικές εκχυλίσεις της d-9-THCV παράγουν τα αντι-παχυσαρκίας αποτελέσματα περισσότερο αυξάνοντας την ενεργειακή δαπάνη παρά μειώνοντας την πρόσληψη τροφής [Pertwee, 2008]. Ο συγγραφέας επισημαίνει επίσης ότι ένα φάρμακο όπως η d-9-THCV, με ταυτόχρονη παρεμπόδιση των CB1Rs και την ενεργοποίηση των CB2Rs, μπορεί να έχει δυνατότητα για τη διαχείριση διαταραχών όπως η χρόνια ηπατική νόσο και η παχυσαρκία, ιδιαίτερα όταν αυτές σχετίζονται με φλεγμονή.
Διαφορετικές περιεκτικότητες στις ποικιλίες της κάνναβης που διαθέτεται στον δρόμο
Καθώς η d-9-THC είναι το κύριο συστατικό που προκαλεί το επιθυμητό αίσθημα “ευφορικότητας”, οι χρήστες προτιμούν τις ποικιλίες του φυτού με υψηλότερη περιεκτικότητα σε THC. Ιδιαίτερα τα τελευταία 15 χρόνια, τέτοιες παραλλαγές του φυτού ήταν ευρύτερα διαθέσιμες στην “αγορά” του δρόμου και συνήθως αναφέρονται ως “skunk” ή “sinsemilla”. Σε μια μελέτη που έγινε από τους Potter και συνεργάτες, όταν συγκρίθηκε η ισχύς της κάνναβης που κατασχέθηκε από την αστυνομία στην Αγγλία μεταξύ των ετών 1996/8 και 2004/5, η μέση περιεκτικότητα της d-9-THC βρέθηκε να είναι 13,9% περισσότερη στα πιο πρόσφατα έτη, σημαντικά υψηλότερη από αυτά που είχαν καταγραφεί πριν από 10 χρόνια [Potter et al., 2008]. Ωστόσο, το περιεχόμενο της CBD βρέθηκε εξαιρετικά χαμηλό σε πιο πρόσφατους χρόνους. Οι συγγραφείς επίσης διαπίστωσαν ότι σε φυτικές ή ρητινικές μορφές της ουσίας, η μέση περιεκτικότητα σε CBD υπερέβαινε εκείνη της THC. Πιο πρόσφατα, πραγματοποιήθηκε μια μετα-ανάλυση για την αξιολόγηση της δραστικότητας της κάνναβης από το 1970 έως το 2009. Από τις 21 σειρές περιπτώσεων που καλύπτουν διάφορες χώρες, αναφέρθηκε πρόσφατη και συνεπής παγκόσμια αύξηση της δραστικότητας κάνναβης [Cascini et al., 2011].
Τα ευρήματα αυτά υποδεικνύουν ότι οι τρέχουσες τάσεις προτιμήσεως για παραλλαγές σε ποικιλίες υψηλότερου περιεχομένου σε THC συνεπάγονται σημαντικούς κινδύνους για την υγεία, ιδιαίτερα σε εκείνους που είναι επιρρεπείς στις επιβλαβείς επιδράσεις της. Πράγματι, στην εργασία των Morgan και συνεργάτες πραγματοποίησαν μελέτη σε 120 τρέχοντες χρήστες, στους οποίους συμμετείχαν 66 καθημερινοί χρήστες και 54 χρήστες για ψυχαγωγικούς σκοπούς, οι αναλύσεις στα μαλλιά τους αποκάλυψαν τα ποσά των THC και CBD. Η μελέτη διαπίστωσε ότι τα υψηλότερα επίπεδα THC στα μαλλιά στους καθημερινούς χρήστες συσχετίστηκαν με αυξημένη κατάθλιψη και άγχος, καθώς και με φτωχότερη ανάκληση πρόζας και μνήμη πηγής [Morgan et al., 2011]. Ωστόσο, η υψηλότερη CBD στα μαλλιά συσχετίστηκε με χαμηλότερα συμπτώματα τύπου ψύχωσης και με καλύτερη μνήμη αναγνώρισης. Σε σχέση με τους ανθρώπους με ψύχωση, οι κίνδυνοι για την υγεία είναι ακόμη μεγαλύτεροι με τις ισχυρότερες παραλλαγές του φυτού. Σε μια πρόσφατη μελέτη ατόμων με ένα πρώτο επεισόδιο ψύχωσης, διαπιστώθηκε ότι οι ασθενείς χρησιμοποίησαν κάνναβη υψηλότερης δραστικότητας για μεγαλύτερη διάρκεια και μεγαλύτερη συχνότητα σε σύγκριση με μια υγιή ομάδα ελέγχου [Di Forti et al., 2009].
Καθώς οι ισχυρότερες παραλλαγές στις ποικιλίες ανέλαβαν την αγορά του δρόμου, παρατηρήθηκε έντονο ενδιαφέρον για τη μελέτη των δεσμών μεταξύ της χρήσης κάνναβης και των προβλημάτων ψυχικής υγείας. Το πρώτο που επέστησε την προσοχή σε έναν τέτοιο σύνδεσμο ήταν μια σειρά επιδημιολογικών μελετών και ανασκοπήσεων, οι οποίες επεσήμαναν τη συσχέτιση μεταξύ της χρήσης κάνναβης και του αυξημένου κινδύνου εμφάνισης ψυχωσικής νόσου με δοσοεξαρτώμενο τρόπο [Zammit et al., 2002, Arseneault et al., 2002, Moore et al., 2007]. Ένα ψυχωτικό αποτέλεσμα δεν είναι η μόνη διαγνωστική κατηγορία που συνδέεται με τη χρήση κάνναβης. Τα συμπτώματα της κατάθλιψης και του άγχους συνήθως συνυπάρχουν με τη χρήση κάνναβης και οδηγούν σε διαγνωστικά διλήμματα [Nunes et al., 2006, Dakwar et al., 2011]. Η χρήση κάνναβης μπορεί να προκαλέσει τέτοια συμπτώματα, καθώς και να χρησιμοποιηθεί δευτερογενώς σε μια πρωτογενή καταθλιπτική νόσο [Dakwar et al., 2011, Fairman and Anthony, 2012]. Καθώς η πλειονότητα των μελετών έδειξαν ψυχωσική ασθένεια, σε αυτό το τμήμα θα επικεντρωθούμε κυρίως σε αυτή τη διαγνωστική κατηγορία.
Ενδιάμεση διαφοροποίηση ως απάντηση στα ψυχογενή αποτελέσματα της κάνναβης
Περίπου το 18,5% των ανθρώπων στο Ηνωμένο Βασίλειο χρησιμοποιούν τακτικά κάνναβη [Atha, 2005]. Αυτό είναι σημαντικό, καθώς η χρήση των παραλλαγών με ποικιλίες κάνναβης με ισχυρές περιεκτικότητες σε THC αυξάνονται δραματικά, οδηγούν σε ανησυχία για τους κινδύνους στην υγεία που σχετίζονται με την κάνναβη, ιδίως για τους νέους [Hall and Degenhardt, 2007, Potter et al., 2008, EMCDDA, 2011]. Πρόσφατες επιδημιολογικές μελέτες δείχνουν τη σχέση μεταξύ της χρήσης κάνναβης και της ανάπτυξης ψυχωσικής ασθένειας [Zammit et al., 2002, van Os et al., 2002, Arseneault et al., 2002, Henquet et al., 2005]. Περαιτέρω στοιχεία προέρχονται από τη συστηματική ανασκόπηση των διαχρονικών και πληθυσμιακών μελετών που δείχνουν ότι η χρήση κάνναβης αυξάνει σημαντικά τον κίνδυνο ανάπτυξης ψυχωσικής νόσου κατά τρόπο εξαρτώμενο από τη δόση [Moore et al., 2007].
Ωστόσο, μόνο μια μικρή μειονότητα αναπτύσσει μια ψυχική ασθένεια πλήρους εμφυσήσεως με τη μορφή σχιζοφρένειας ή διπολικής διαταραχής, ενώ μια μεγαλύτερη ομάδα, που κυμαίνεται από 15% έως 50%, παρουσιάζει παροδικά ψυχωτικά συμπτώματα μικρής διάρκειας, από μερικές ώρες έως και μια εβδομάδα και συνήθως ανακτώνται χωρίς να απαιτείται κάποια παρέμβαση [Thomas, 1996, Green et al., 2003, D’Souza et al., 2004, 2009, Morrison et al., 2009]. Πράγματι, οι μελέτες πρόκλησης φαρμάκων με d-9-THC σε υγιείς εθελοντές έχουν δείξει ένα ευρύ φάσμα παροδικών συμπτωμάτων, συμπεριφορών και γνωστικών ελλειμμάτων που κυμαίνονται από άγχος έως ψύχωση σε παροδική διαταραχή της μνήμης [D’Souza et al., 2004, Curran et al., 2002, Morrison et al., 2009]. Η κλινική εικόνα της παροδικής ψύχωσης μπορεί να μην διακρίνεται από μια ειλικρινή οξεία ψύχωση με παραισθήσεις και ψευδαισθήσεις, εκτός από τη σύντομη διάρκεια της.
Είναι προφανές ότι υπάρχουν σημαντικές διαφορές στις επιδράσεις της κάνναβης στα άτομα. Η βιολογική βάση αυτής της μεταβλητής ευαισθησίας είναι ακόμη ασαφής. Έχουν διεξαχθεί αρκετές μελέτες που εξετάζουν ποιες ομάδες είναι πιο ευάλωτες στην ανάπτυξη ψυχωτικής έκβασης ως αποτέλεσμα της χρήσης κάνναβης [van Os et al., 2002, Henquet et al., 2004]. Τα ευρήματα μέχρι τώρα δείχνουν ότι η επίδραση της χρήσης κάνναβης είναι πολύ ισχυρότερη σε εκείνους με οποιαδήποτε προδιάθεση για ψύχωση κατά την έναρξη από ότι σε εκείνους χωρίς [Henquet et al., 2005]. Πράγματι, τα άτομα με προδιάθεση για ψύχωση που υποδεικνύεται από θετικό οικογενειακό ιστορικό ψύχωσης έχουν βρεθεί ότι είναι ιδιαίτερα ευαίσθητα στις επιδράσεις της κάνναβης [McGuire et al., 1995]. Ένας άλλος δείκτης για υψηλότερο κίνδυνο ψύχωσης είναι η παρουσία υποκλινικών ψυχωτικών χαρακτηριστικών και πάλι τέτοια άτομα έχουν επηρεαστεί από υψηλότερο κίνδυνο ανάπτυξης ψυχωσικής νόσου [Henquet et al., 2004]. Επιπλέον, όσοι βρίσκονται σε εξαιρετικά υψηλό κίνδυνο ψύχωσης έχει αναφερθεί ότι είναι πιο ευαίσθητοι στις ψυχογενείς επιδράσεις της κάνναβης σε σύγκριση με τους χρήστες του γενικού πληθυσμού [Peters et al., 2009].
Λόγω των αναφερθέντων δεσμών μεταξύ της σχιζοτυπικής προσωπικότητας και της σχιζοφρένειας, αυτός ο τύπος διαταραχής της προσωπικότητας έχει εξεταστεί διεξοδικά στην εξέταση του ρόλου της κάνναβης στην παραγωγή ψυχωτικών συμπτωμάτων. Πράγματι, έχει αποδειχθεί ότι οι άνθρωποι με υψηλή συχνότητα σχιζοτύπου που χρησιμοποιούν κάνναβη είναι πιο πιθανό να έχουν εμπειρίες παρόμοιες με την ψύχωση κατά τη στιγμή της χρήσης, μαζί με δυσάρεστες παρενέργειες [Barkus et al., 2006]. Αυτή η μελέτη έχει επαναληφθεί και έχει επιβεβαιωθεί ότι εκείνοι με σχιζοτυπική διαταραχή προσωπικότητας φέρουν υψηλότερο κίνδυνο εμφάνισης ψυχωσικών συμπτωμάτων με χρήση κάνναβης [Stirling et al., 2008]. Πρόσφατα, μια άλλη μελέτη παρέχει περαιτέρω υποστήριξη για μια ισχυρή συσχέτιση μεταξύ της πρώιμης χρήσης κάνναβης και της ανάπτυξης συμπτωμάτων διαταραχής φάσματος σχιζοφρένειας [Anglin et al., 2012].
Οι αναφερόμενοι παράγοντες ευπάθειας που αναφέρθηκαν εδώ συνεπάγονται ισχυρή γενετική προδιάθεση και υπήρξαν αρκετές μελέτες που εξετάζουν ιδιαίτερα συγκεκριμένα γονίδια που έχουν εμπλακεί σε ψυχώσεις. Η πρώτη τέτοια μελέτη διεξήχθη από τους Caspi και συνεργάτες [Caspi et al., 2005]. Σε αυτή τη διαχρονική μελέτη, εξετάστηκε ένα ειδικό γονίδιο ευαισθησίας που συνδέθηκε με τη σχιζοφρένεια και τη διπολική διαταραχή, η κατεχολ-Ο-μεθυλοτρανσφεράση (catechol-O-methyltransferase, COMT), εξετάστηκε σε μια αντιπροσωπευτική ομάδα από την γέννηση ακολουθούμενη έως την ενηλικίωση. Η μελέτη διαπίστωσε ότι οι φορείς του αλληλόμορφου COMT βαλίνης158 ήταν πιο πιθανό να παρουσιάσουν ψυχωσικά συμπτώματα και να αναπτύξουν σχιζοφρενοειδή διαταραχή εάν χρησιμοποιούσαν κάνναβη πριν από την ηλικία των 15 ετών. Ωστόσο, ο αριθμός των ατόμων που έφεραν αυτό το αλληλόμορφο ήταν μικρός σε αυτή τη μελέτη. Χρησιμοποιώντας ένα σχέδιο μόνο 493 ατόμων με σχιζοφρένεια, οι Zammit και συνεργάτες επανεξέτασαν αυτή τη συσχέτιση, αλλά τα ευρήματά τους δεν υποστηρίζουν τις διάφορες επιδράσεις της χρήσης κάνναβης στη σχιζοφρένεια σύμφωνα με την παραλλαγή του COMT [Zammit et al., 2007]. Η ομάδα των Zammit και συνεργάτες επίσης εξέτασε την αλληλεπίδραση μεταξύ της χρήσης κάνναβης και του γονότυπου COMT, περιορίζοντας την ανάλυση σε συμμετέχοντες που ισχυρίστηκαν ότι χρησιμοποίησαν για πρώτη φορά κάνναβη κατά την ίδια περίοδο αποκοπής όπως και στην μελέτη της ομάδας Caspi και συνεργάτες, αλλά δεν κατάφεραν να βρουν στοιχεία που να υποστηρίζουν τη σύνδεση.
Πρόσφατα, οι Van Winkel και συνεργάτες εξέτασαν τα αποτελέσματα της πρόσφατης χρήσης κάνναβης εξετάζοντας 152 πολυμορφισμούς ενός νουκλεοτιδίου σε 42 υποψήφια γονίδια σε 801 ασθενείς με ψύχωση και σε 740 μη επηρεασμένα αδέλφια τους [van Winkel et al., 2011]. Οι συγγραφείς διαπίστωσαν ότι η γενετική παραλλαγή σε πρωτεϊνική κινάση σερίνης-θρεονίνης (serine-threonine protein kinase, AKT1) μπορεί να προκαλέσει τόσο βραχυπρόθεσμες όσο και μακροπρόθεσμες επιπτώσεις στην έκφραση της ψύχωσης που σχετίζεται με τη χρήση κάνναβης. Οι συγγραφείς προτείνουν ότι ο πιθανός μηχανισμός θα μπορούσε να είναι ο ρυθμισμένος προς τα κάτω με κανναβινοειδές της σηματοδότησης ΑΚΤ1/γλυκογόνου συνθάσης κινάσης 3 του υποδοχέα D2 της ντοπαμίνης. Πράγματι, οι αγωνιστές CB1R έχουν δειχθεί ότι επάγουν φωσφορυλίωση ΑΚΤ1, ενώ οι ανταγωνιστές αυτού του υποδοχέα έχουν αναστείλει μονοπάτια σηματοδότησης ΑΚΤ1 [Molina-Holgado et al., 2002]. Περαιτέρω υποστήριξη για την πιθανή συμμετοχή του γονιδίου AKT1 προέρχεται από τη μελέτη μας με υγιείς εθελοντές. Αυτή η μελέτη διαπίστωσε ότι, κατά τη διάρκεια διαδικασιών των συνθηκών κωδικοποίησης και ανάκλησης λεκτικής μνήμης, η επαγωγή ψυχωτικών συμπτωμάτων από d-9-THC συσχετίστηκε με την εξασθενημένη ενεργοποίηση ραβδωτού και μεσεγκεφάλου μόνο σε όσους ήταν Ο ομοζυγώτες της ΑΚΤ1 και φορείς του 9-αλληλόμορφου μεταφορέα ντοπαμίνης (DAT1) [Bhattacharyya et al., 2012] (Πίνακας 2).

Εκτός από τη σχιζοτυπική προσωπικότητα, οι παράγοντες ευπάθειας στις ψυχογενείς επιδράσεις της κάνναβης απαιτούν επανάληψη. Είναι σαφές ότι πρέπει να διεξαχθούν περαιτέρω εργασίες για να διερευνηθούν οι βιολογικοί μηχανισμοί που καθορίζουν την ευπάθεια προς ένα ψυχωτικό αποτέλεσμα.
Συμπέρασμα
Κατά την τελευταία δεκαετία, η ενδοκανναβινοειδής έρευνα υπήρξε ένας από τους ταχύτερα αναπτυσσόμενους τομείς της ψυχοφαρμακολογίας, ανοίγοντας τρόπους για την ανακάλυψη νέων φαρμάκων για μια ευρεία ποικιλία προβλημάτων υγείας, που κυμαίνονται από μεταβολικές διαταραχές έως γλαύκωμα και σχιζοφρένεια.
Η κατανομή του ενδοκανναβινοειδούς συστήματος στον εγκέφαλο είναι ενδιαφέρουσα καθώς οι ίδιες περιοχές του εγκεφάλου εμπλέκονται επίσης στις ψυχώσεις, ιδιαίτερα στη σχιζοφρένεια. Επιπλέον, η πολύπλοκη και περίπλοκη εμπλοκή αυτού του συστήματος με άλλους νευροδιαβιβαστές όπως η ντοπαμίνη, το GABA και τα γλουταμινεργικά συστήματα μπορεί να έχουν επιπτώσεις στην ανάπτυξη ψυχωσικής ασθένειας.
Φυσικά, λόγω της πρόσφατης και σταθερής αύξησης της διαθεσιμότητας ποικιλιών με υψηλότερες παραλλαγές σε περιεχόμενο THC της κάνναβης σε όλο τον κόσμο, αυξάνονται οι ανησυχίες σχετικά με τους κινδύνους για την υγεία, ιδίως για τους νέους. Ωστόσο, η κάνναβη επηρεάζει τους ανθρώπους διαφορετικά και ως εκ τούτου είναι σημαντικό να κατανοήσουμε τι κάνει κάποιον πιο εκτεθειμένο σε κίνδυνο και πώς διαφέρει σε σχέση με εκείνους που δεν αναπτύσσουν ψυχωσικές παθήσεις. Εδώ παρουσιάσαμε μια επισκόπηση των διαθέσιμων πληροφοριών σχετικά με τους παράγοντες κινδύνου που μπορεί να θέσουν ένα άτομο σε μεγαλύτερο κίνδυνο, όπως η προδιάθεση για ψύχωση, η σχιζοτυπική προσωπικότητα και ορισμένα γονίδια ευαισθησίας.
Η εύρεση ομάδων που είναι ευάλωτες είναι ιδιαίτερα σημαντική, ώστε να μπορούν να στοχεύουν έγκαιρες προληπτικές και θεραπευτικές παρεμβάσεις. Μια τέτοια έρευνα θα οδηγούσε επίσης στην ανακάλυψη των βιοχημικών μηχανισμών που εμπλέκονται στην έρευνα για την κάνναβη και τα ενδοκανναβινοειδή και τελικά σε μια καλύτερη κατανόηση του τρόπου λειτουργίας του εγκεφάλου και του σώματος.
Ευχαριστίες
Ευχαριστούμε τον Ethan Russo και τον Geoffrey W. Guy για την παροχή της έμπνευσης για τον Πίνακα 1. Επίσης ευχαριστούμε τον Dr. Sanem Atakan για τη βοήθειά του στην επεξεργασία του πρώτου σχεδίου.
Υποσημειώσεις
Χρηματοδότηση: Η συγκεκριμένη έρευνα δεν έλαβε συγκεκριμένη επιχορήγηση από οποιοδήποτε φορέα χρηματοδότησης στους δημόσιους, εμπορικούς ή μη κερδοσκοπικούς τομείς.
Δήλωση σύγκρουσης συμφερόντων
Ο συντάκτης δεν δηλώνει σύγκρουση συμφερόντων κατά την προετοιμασία αυτού του άρθρου.
Βιβλιογραφικές αναφορές
* Anderson B., Rizzo M., Block R., Pearlson G., O’Leary D. (2010)
“Sex, drugs and cognition: effects of marijuana”
(Σεξ, ναρκωτικά και γνωσιακή συμπεριφορά: επιπτώσεις της κάνναβης)
J Psychoactive Drugs 42:413–424
* Anglin D., Corcoran C., Brown A., Chen H., Lighty Q., Brook J., et al. (2012)
“Early cannabis use and schizotypal personality disorder symptoms from adolescence to middle adulthood”
(Πρόωρη χρήση κάνναβης και σχιζοτυπική διαταραχή της προσωπικότητας από την εφηβεία μέχρι τη μέση ενηλικίωση)
Schizophr Res 137:45–49
* Arseneault L., Cannon M., Murray R., Poulton R., Caspi A., Moffitt T. (2002)
“Cannabis use in adolescence and risk for adult psychosis: longitudinal prospective study”
(Η χρήση κάνναβης στην εφηβεία και ο κίνδυνος για ψύχωση των ενηλίκων: διαχρονική προοπτική μελέτη)
BMJ 325:1212–1213
* Atha M. (2005) Independent Drug Monitoring Unit (IDMU)
“Cannabis use in Britain” (http://)www(dot)idmu(dot)co(dot)uk/
(Η χρήση κάνναβης στη Βρετανία)
* Athanasiou A., Clarke A., Turner A., Kumaran N., Vakilpour S., Smith P., et al. (2007)
“Cannabinoid receptor agonists are mitochondrial inhibitors: a unified hypothesis of how cannabinoids modulate mitochondrial function and induce cell death”
(Οι αγωνιστές υποδοχέα κανναβινοειδών είναι μιτοχονδριακοί αναστολείς: μια ενιαία υπόθεση για το πώς τα κανναβινοειδή ρυθμίζουν τη λειτουργία των μιτοχονδρίων και προκαλούν τον κυτταρικό θάνατο)
Biochem Biophys Res Commun 364:131–137
* Barkus E., Stirling J., Hopkins R., Lewis S. (2006)
“Cannabis-induced psychosis-like experiences are associated with high schizotypy”
(Οι επαγόμενες από την κάνναβη παρόμοιες με ψύχωση εμπειρίες σχετίζονται με υψηλό σχιζοτύπο)
Psychopathology 39:175–178
* Batkai S., Pacher P., Osei-Hyiaman D., Radaeva S., Liu J., Harvey-White J., et al. (2004)
“Endocannabinoids acting at cannabinoid-1 receptors regulate cardiovascular function in hypertension”
(Τα ενδοκανναβινοειδή που δρουν στους υποδοχείς κανναβινοειδών-1 ρυθμίζουν την καρδιαγγειακή λειτουργία στην υπέρταση)
Circulation 110:1996–2002
* Benowitz N., Jones R. (1981)
“Cardiovascular and metabolic considerations in prolonged cannabinoid administration in man”
(Καρδιαγγειακές και μεταβολικές εκτιμήσεις σε παρατεταμένη χορήγηση κανναβινοειδών στον άνθρωπο)
J Clin Pharmacol 21:214S–223S
* Bhattacharyya S., Atakan Z., Martin-Santos R., Crippa J., Kambeitz J., Prata D., et al. (2012)
“Preliminary report of biological basis of sensitivity to the effects of cannabis on psychosis: AKT1 and DAT1 genotype modulates the effects of delta-9-tetrahydrocannabinol on midbrain and striatal function”
(Προκαταρκτική αναφορά της βιολογικής βάσης ευαισθησίας στις επιδράσεις της κάνναβης στην ψύχωση: Ο γονότυπος AKT1 και DAT1 ρυθμίζει τις επιδράσεις της δέλτα-9-τετραϋδροκανναβινόλης στη λειτουργία του μεσεγκεφάλου και του ραβδωτού σώματος)
Mol Psychiatry 17(12):1152-5
* Bhattacharyya S., Crippa J., Martin-Santos R., Winton-Brown T., Fusar-Poli P. (2009a)
“Imaging the neural effects of cannabinoids: current status and future opportunities for psychopharmacology”
(Απεικόνιση των νευρωνικών επιδράσεων των κανναβινοειδών: τρέχουσα κατάσταση και μελλοντικές ευκαιρίες για ψυχοφαρμακολογία)
Curr Pharm Des 15:2603–2614
* Bhattacharyya S., Fusar-Poli P., Borgwardt S., Martin-Santos R., Nosarti C., O’Carroll C., et al. (2009b)
“Modulation of mediotemporal and ventrostriatal function in humans by delta-9-tetrahydrocannabinol: a neural basis for the effects of Cannabis sativa on learning and psychosis”
(Διαμόρφωση της μεσοποριακής και κοιλιακής λειτουργίας σε ανθρώπους από δέλτα-9-τετραϋδροκανναβινόλη: μια νευρική βάση για τις επιδράσεις του Cannabis sativa στη μάθηση και την ψύχωση)
Arch Gen Psychiatry 66:442–451
* Bhattacharyya S., Morrison P., Fusar-Poli P., Martin-Santos R., Borgwardt S., Winton-Brown T., et al. (2010)
“Opposite effects of delta-9-tetrahydrocannabinol and cannabidiol on human brain function and psychopathology”
(Αντίθετα αποτελέσματα της δέλτα-9-τετραϋδροκανναβινόλης και της κανναβιδιόλης στη λειτουργία του ανθρώπινου εγκεφάλου και την ψυχοπαθολογία)
Neuropsychopharmacology 35:764–774
* Borgwardt S., Allen P., Bhattacharyya S., Fusar-Poli P., Crippa J., Seal M., et al. (2008)
“Neural basis of Δ-9-tetrahydrocannabinol and cannabidiol: effects during response inhibition”
(Νευρωνική βάση της Δ-9-τετραϋδροκανναβινόλης και της κανναβιδιόλης: αποτελέσματα κατά την αναστολή της απόκρισης)
Biol Psychiatry 64:966–973
* Callén L., Moreno E., Barraso-Chinea P., Moreno-Delgado D., Cortes A., Mallol J., et al. (2012)
“Cannabinoid receptors CB1 and CB2 form functional heteromers in the brain”
(Οι υποδοχείς των κανναβινοειδών CB1 και CB2 σχηματίζουν λειτουργικά ετερομερή στον εγκέφαλο)
J Biol Chem 287:20851-20865
* Carlini E., Karniol I., Renault P., Schuster C. (1974)
“Effects of marihuana in laboratory animals and in man”
(Επιδράσεις της κάνναβης σε εργαστηριακά ζώα και στον άνθρωπο)
Br J Pharmacol 50:299–309
* Cascini F., Aiello C., Di Tanna G. (2011)
“Increasing delta-9-tetrahydrocannabinol (Δ-9-THC) content in herbal cannabis over time: systematic review and meta-analysis”
(Αύξηση της περιεκτικότητας σε δέλτα-9-τετραϋδροκανναβινόλη (Δ-9-THC) στη φυτική κάνναβη με την πάροδο του χρόνου: συστηματική ανασκόπηση και μετα-ανάλυση)
Curr Drug Abuse Rev 5:32-40
* Caspi A., Moffitt T., Cannon M., McClay J., Murray R., Harrington H., et al. (2005)
“Moderation of the effect of adolescent-onset cannabis use on adult psychosis by a functional polymorphism in the catechol-O-methyltransferase gene: longitudinal evidence of a gene X environment interaction”
(Μετρίαση της επίδρασης της χρήσης κάνναβης σε εφήβους στην ψύχωση ενήλικα από λειτουργικό πολυμορφισμό στο γονίδιο κατεχόλης-Ο-μεθυλοτρανσφεράσης: διαχρονική απόδειξη αλληλεπίδρασης γονιδίου Χ)
Biol Psychiatry 57:1117–1127
* Costa B., Trovato A., Comellii F., Giagnoni G., Colleoni M. (2007)
“The non-psychoactive cannabis constituent cannabidiol is an orally effective therapeutic agent in rat chronic inflammatory and neuropathic pain”
(Το μη ψυχοδραστικό συστατικό της κάνναβης, η κανναβιδιόλη είναι ένας από του στόματος αποτελεσματικός θεραπευτικός παράγοντας στον χρόνιο φλεγμονώδη και νευροπαθητικό πόνο σε αρουραίο)
Eur J Pharmacol 556:75–83
* Crippa J., Derenusson G., Ferrari T., Wichert-Ana L., Duran F., Martin-Santos R., et al. (2011)
“Neural basis of anxiolytic effects of cannabidiol (CBD) in generalized social anxiety disorder: apreliminary report”
(Νευρωνική βάση αγχολυτικών επιδράσεων της κανναβιδιόλης (CBD) στη γενικευμένη διαταραχή του κοινωνικού άγχους: μια προκαταρκτική έκθεση)
J Psychopharmacol 25:121–130
* Crippa J., Zuardi A., Martin-Santos R., Bhattacharyya S., Atakan Z., McGuire P., et al. (2009)
“Cannabis and anxiety: a critical review of the evidence”
(Η κάνναβη και το άγχος: μια κριτική επισκόπηση των στοιχείων)
Hum Psychopharmacol 7:515–523
* Curran H., Brignell C., Fletcher S., Middleton P., Henry J. (2002)
“Cognitive subjective dose–response effects of acute oral delta 9-tetrahydrocannabinol (THC) in infrequent cannabis users”
(Γνωστικές υποκειμενικές επιδράσεις δόσης-απόκρισης της οξείας από του στόματος δέλτα 9-τετραϋδροκανναβινόλης (THC) σε ευκαιριακούς χρήστες κάνναβης)
Psychopharmacology 164:61–70
* Dakwar E., Nunes E., Bisaga A., Carpenter K., Mariani J., Sullivan M., et al. (2011)
“A comparison of independent depression and substance-induced depression in cannabis-, cocaine-, and opioid-dependent treatment seekers”
(Μια σύγκριση της ανεξάρτητης κατάθλιψης και της κατάθλιψης που προκαλείται από ουσία στους αιτούντες θεραπεία σχετικά με την εξάρτηση από την κάνναβη, την κοκαΐνη και τα οπιοειδή)
Am J Addict 20:441–446
* Degenhardt L., Coffey C., Carlin J., Swift W., Moore E., Patton G. (2010)
“Outcomes of occasional cannabis use in adolescence: 10-year follow-up study in Victoria, Australia”
(Αποτελέσματα περιστασιακής χρήσης κάνναβης στην εφηβεία: 10ετής μελέτη παρακολούθησης στη Βικτώρια της Αυστραλίας)
Br J Psychiatry 196:290–295
* De Meijer E., Bagatta M., Carboni A., Crucitti P., Moliterni V., Ranalli P., et al. (2003)
“The inheritance of chemical phenotype in Cannabis sativa L.”
(Η κληρονομικότητα του χημικού φαινοτύπου στην Cannabis sativa L.)
Genetics 63:335–346
* Devane W., Dysarz F., Johnson M., Melvin L., Howlett A. (1988)
“Determination and characterization of a cannabinoid receptor in rat brain”
(Προσδιορισμός και χαρακτηρισμός ενός κανναβινοειδούς υποδοχέα στον εγκέφαλο αρουραίου)
Mol Pharmacol 34:605–613
* Devane W., Hanus L., Breuer A., Pertwee R., Stevenson L., Griffin G., et al. (1992)
“Isolation and structure of a brain constituent that binds to the cannabinoid receptor”
(Απομόνωση και δομή ενός συστατικού του εγκεφάλου που δεσμεύεται στον υποδοχέα κανναβινοειδών)
Science 258:1946–1949
* Dewey W. (1986)
“Cannabinoid pharmacology”
(Κανναβινοειδής φαρμακολογία)
Pharmacol Rev 38:151–178
* Di Forti M., Morgan C., Dazzan P., Pariente C., Mondelli V., Marques T., et al. (2009)
“High-potency cannabis and the risk of psychosis”
(Η κάνναβη υψηλής δραστικότητας και ο κίνδυνος ψύχωσης)
Br J Psychiatry 195:488–491
* Di Marzo V., Piscitelli F. (2011)
“Gut feelings about the endocannabinoid system”
(Σκέψεις για το ενδοκανναβινοειδές σύστημα)
Neurogastroenterol Motil 23:391–398
* Di Marzo V., Piscitelli F., Mechoulam R. (2011)
“Cannabinoids and endocannabinoids in metabolic disorders with focus on diabetes”
(Κανναβινοειδή και ενδοκανναβινοειδή σε μεταβολικές διαταραχές με έμφαση στον διαβήτη)
Handb Exp Pharmacol 203:75–104
* D’Souza D., Perry E., MacDougall L., Ammerman Y., Cooper T., Wu Y., et al. (2004)
“The psychotomimetic effects of intravenous delta-9-tetrahydrocannabinol in healthy individuals: implications for psychosis”
(Οι ψυχομιμητικές επιδράσεις της ενδοφλέβιας δέλτα-9-τετραϋδροκανναβινόλης σε υγιή άτομα: επιπτώσεις στην ψύχωση)
Neuropsychopharmacology 29:1558–1572
* D’Souza D., Sewell R., Ranganathan M. (2009)
“Cannabis and psychosis/schizophrenia: human studies”
(Η κάνναβη και η ψύχωση/σχιζοφρένεια: ανθρώπινες μελέτες)
Eur Arch Psychiatry Clin Neurosci 259:413–431
* EMCDDA (European Monitoring Centre for Drugs and Drug Addiction / Ευρωπαϊκό Κέντρο Παρακολούθησης Ουσιών και Τοξικομανίας) (2011)
Annual Report 2011: The State of the Drug Problems in Europe
(Ετήσια έκθεση 2011: Η κατάσταση των προβλημάτων των ναρκωτικών στην Ευρώπη) Λισαβόνα: EMCDDA
βλ. και “European Drug Report 2017: Trends and Developments”
(Ευρωπαϊκή έκθεση για τα ναρκωτικά 2017: Τάσεις και εξελίξεις) http://www.emcdda.europa.eu/publications/edr/trends-developments/2017_en
* Fairman B., Anthony J. (2012)
“Are early-onset cannabis smokers at an increased risk of depression spells?”
(Είναι οι καπνιστές κάνναβης που έχουν ξεκινήσει από νωρίς σε αυξημένο κίνδυνο κατάθλιψης;)
J Affect Disord 138:54–62
* Ferré S., Goldberg S., Lluis C., Franco R. (2009)
“Looking for the role of cannabinoid receptor heteromers in striatal function”
(Ψάχνουμε για το ρόλο των ετερομερών του υποδοχέα κανναβινοειδών στην λειτουργία του ραβδωτού)
Neuropharmacology 56(Suppl.1):226–234
* Fusar-Poli P., Crippa J., Bhattacharyya S., Borgwardt S., Allen P., Martin-Santos R., et al. (2009)
“Distinct effects of delta-9-tetrahydrocannabinol and cannabidiol on neural activation during emotional processing”
(Διακριτές επιδράσεις της δέλτα-9-τετραϋδροκανναβινόλης και της κανναβιδιόλης στη νευρική ενεργοποίηση κατά τη διάρκεια της συναισθηματικής επεξεργασίας)
Arch Gen Psychiatry 66:95–105
* Gaoni Y., Mechoulam R. (1964)
“Isolation, structure and partial synthesis of an active constituent of hashish”
(Απομόνωση, δομή και μερική σύνθεση ενός δραστικού συστατικού του χασίς)
J Am Chem Soc 86:1646–1647
* Gorelick D., Heishman S. (2006)
“Methods for clinical research involving cannabis administration”
(Μέθοδοι κλινικής έρευνας που αφορούν τη χορήγηση κάνναβης)
Methods Mol Med 123:235–253
* Green B., Kavanagh D., Young R. (2003)
“Being stoned: a review of self-reported cannabis effects”
(Σε κατάσταση ευφορικότητας: ανασκόπηση των αποτελεσμάτων της κάνναβης από αυτο-αναφορές)
Drug Alcohol Rev 22:453–460
* Green K. (1998)
“Marijuana smoking vs cannabinoids for glaucoma therapy”
(Κάπνισμα κάνναβης εναντίον κανναβινοειδών για θεραπεία γλαυκώματος)
Arch Ophthalmol 116:1433–1437
* Hall W., Degenhardt L. (2007)
“Prevalence and correlates of cannabis use in developed and developing countries”
(Επικράτηση και συσχετισμός χρήσης κάνναβης σε αναπτυγμένες και αναπτυσσόμενες χώρες)
Curr Opin Psychiatry 20:393–397
* Hayakawa K., Mishima K., Hazekawa M., Sano K., Orito K., et al. (2008)
“Cannabidiol potentiates pharmacological effects of delta(9)-tetrahydrocannabinol via CB(1) receptor-dependent mechanism”
(Η κανναβιδιόλη ενισχύει τις φαρμακολογικές επιδράσεις της δέλτα(9)-τετραϋδροκανναβινόλης μέσω του μηχανισμού που εξαρτάται από τον υποδοχέα CB(1))
Brain Res 1888:157–164
* Henquet C., Krabbendam L., Spauwen J., Kaplan C., Lieb R., Wittchen H., et al. (2004)
“Prospective cohort study of cannabis use, predisposition for psychosis, and psychotic symptoms in young people”
(Προοπτική μελέτη κοόρτης της χρήσης κάνναβης, προδιάθεση για ψύχωση και για ψυχωσικά συμπτώματα στους νέους)
BMJ 330:11–14
και
Henquet C., Krabbendam L., Spauwen J., Kaplan C., Lieb R., Wittchen H., et al. (2005)
“Prospective cohort study of cannabis use, predisposition for psychosis and psychotic symptoms in young people”
(Προοπτική μελέτη κοόρτης χρήσης της κάνναβης, προδιάθεση για ψύχωση και για ψυχωσικά συμπτώματα στους νέους)
BMJ 330:11
* Howlett A., Barth F., Bonner T., Cabral G., Casellas P., Devane W., et al. (2002)
“International Union of Pharmacology. XXVII. Classification of cannabinoid receptors”
(Διεθνής Ένωση Φαρμακολογίας. XXVII. Ταξινόμηση των υποδοχέων κανναβινοειδών)
Pharmacol Rev 54:161–202
* Iwamura H., Suzuki H., Ueda Y., Kaya T., Inaba T. (2001)
“In vitro and in vivo pharmacological characterization of JTE-907, a novel selective ligand for cannabinoid CB2 receptor”
(In vitro και in vivo φαρμακολογικός χαρακτηρισμός του JTE-907, ένας νέος εκλεκτικός προσδέτης για υποδοχέα κανναβινοειδούς CB2)
J Pharmacol Exp Ther 296:420–425
* Izzo A. (2004)
“Cannabinoids and intestinal motility: welcome to CB2 receptors”
(Κανναβινοειδή και κινητικότητα του εντέρου: Καλώς ήλθατε στους υποδοχείς CB2)
Br J Pharmacol 142:1201–1202
* Juknat A., Rimmerman N., Levy R., Vogel Z., Kozela E. (2011)
“Cannabidiol affects the expression of genes involved in zinc homeostasis in BV-2 microglial cells”
(Η κανναβιδιόλη επηρεάζει την έκφραση των γονιδίων που εμπλέκονται στην ομοιοστασία του ψευδαργύρου σε μικρογλοιακά κύτταρα BV-2)
Neurochem Int 9 December.
* Karniol I., Carlini E. (1973)
“Comparative studies in man and in laboratory animals on 8- and 9-trans-tetrahydrocannabinol”
(Συγκριτικές μελέτες σε ανθρώπους και σε πειραματόζωα σε 8- και 9-trans-τετραϋδροκανναβινόλη)
Pharmacology 9:115–126
* Karniol I., Shirikawa I., Kasinski N., Pfefermen A., Carlini E. (1974)
“Cannabidiol interferes with the effects of delta-9-tetrahydrocannabinol in man”
(Η κανναβιδιόλη παρεμποδίζει τις επιδράσεις της δέλτα-9-τετραϋδροκανναβινόλης στον άνθρωπο)
Eur J Pharmacol 28:172–77
* Kenney S., Kekuda R., Prasad P., Leibach F., Devoe L., Ganapathy V. (1999)
“Cannabinoid receptors and their role in the regulation of the serotonin transporter in human placenta”
(Οι υποδοχείς κανναβινοειδών και ο ρόλος τους στη ρύθμιση του μεταφορέα σεροτονίνης στον ανθρώπινο πλακούντα)
Am J Obstet Gynecol 181:491–497
* Lakhan S., Rowland M. (2009)
“Whole plant cannabis extracts in the treatment of spasticity in multiple sclerosis: a systematic review”
(Εκχυλίσματα κάνναβης ολόκληρων φυτών στη θεραπεία της σπαστικότητας στην πολλαπλή σκλήρυνση: συστηματική ανασκόπηση)
BMC Neurol 9:59
* Li H. (1973)
“An archaeological and historical account of cannabis in China”
(Αρχαιολογικός και ιστορικός απολογισμός της κάνναβης στην Κίνα)
Economic Botany 28:437–448
* Mackie K., Stella N. (2006)
“Cannabinoid receptors and endocannabinoids: evidence for new players”
(Οι υποδοχείς των κανναβινοειδών και τα ενδοκανναβινοειδή: στοιχεία για τους νέους παίκτες)
AAPS J 8:E298–E306
* Marcellino D., Carriba P., Filip M., Borgkvist A., Frankowska M., Bellido I., et al. (2008)
“Antagonistic cannabinoid CB1/dopamine D2 receptor interactions in striatal CB1/D2 heteromers. A combined neurochemical and behavioral analysis”
(Ανταγωνιστικές αλληλεπιδράσεις υποδοχέα CB1/ντοπαμίνης D2 κανναβινοειδούς σε ραβδωτά CB1/D2 ετερομερή. Μια συνδυασμένη ανάλυση νευροχημικών και συμπεριφορικών)
Neuropharmacology 54:815–823
* Matsuda L., Lolait S., Brownstein M., Young A., Bonner T. (1990)
“Structure of a cannabinoid receptor and functional expression of the cloned cDNA”
(Δομή ενός κανναβινοειδούς υποδοχέα και λειτουργική έκφραση του κλωνοποιημένου cDNA)
Nature 346:561–564
* McGuire P., Jones P., Harvey I., Williams M., McGuffin P., Murray R. (1995)
“Morbid risk of schizophrenia for relatives of patients with cannabis-associated psychosis”
(Νοσηρός κίνδυνος σχιζοφρένειας για συγγενείς ασθενών με ψύχωση που σχετίζεται με την κάνναβη)
Schizophr Res 15:277–281
* Mechoulam R., Ben-Shabat S., Hanuš L., Ligumsky M., Kaminski N., Schatz A., et al. (1995)
“Identification of an endogenous 2-monoglyceride, present in canine gut, that binds to cannabinoid receptors”
(Ταυτοποίηση ενός ενδογενούς 2-μονογλυκεριδίου, που υπάρχει στο έντερο σκύλου, που δεσμεύεται με υποδοχείς κανναβινοειδών)
Biochem Pharmacol 50:83–90
* Mechoulam R., Hanus L. (2000)
“A historical overview of chemical research on cannabinoids”
(Μια ιστορική επισκόπηση της χημικής έρευνας για τα κανναβινοειδή)
Chems Phys Lipids 108:1–13
* Mechoulam R., Shvo Y. (1963)
“Hashish. I. The structure of cannabidiol”
(Χασίς. I. Η δομή της κανναβιδιόλης)
Tetrahedron 19:2073–2078
* Molina-Holgado E., Vela J., Arévalo-Martin A., Almazán G., Molina-Holgado F., Borrell J., et al. (2002)
“Cannabinoids promote oligodendrocyte progenitor survival: involvement of cannabinoid receptors and phosphatidylinositol-3 kinase/Akt signalling”
(Τα κανναβινοειδή προάγουν την επιβίωση προγονικών ολιγοδενδροκυττάρων: εμπλοκή των υποδοχέων κανναβινοειδών και σηματοδότηση της φωσφατιδυλινοσιτόλης-3 κινάσης/Akt)
J Neurosci 22:9742–9753
* Moore T., Zammit S., Lingford-Hughes A., Barnes T., Jones P., Burke M., et al. (2007)
“Cannabis use and risk of psychotic or affective mental health outcomes: a systematic review”
(Χρήση κάνναβης και κίνδυνος ψυχωσικών ή συναισθηματικών αποτελεσμάτων ψυχικής υγείας: συστηματική ανασκόπηση)
Lancet 370:319–328
* Moreira F., Guimaraes F. (2005)
“Cannabidiol inhibits the hyperlocomotion induced by psychotomimetic drugs in mice”
(Η κανναβιδιόλη αναστέλλει την υπερκινητικότητα που προκαλείται από τα ψυχομιμητικά φάρμακα σε ποντίκια)
Eur J Pharmacol 512:199–205
* Morgan C., Gardener C., Schafer G., Swan S., Demarchi C., Freeman T., et al. (2011)
“Sub-chronic impact of cannabinoids in street cannabis on cognition, psychotic-like symptoms and psychological well-being”
(Υποχρονική επίδραση των κανναβινοειδών στην κάνναβη του δρόμου στη γνωστική λειτουργία, ψυχωτικά συμπτώματα και ψυχολογική ευεξία)
Psychol Med 29:1–10
* Morgan C., Schafer G., Freeman T., Curran H. (2010)
“Impact of cannabidiol on the acute memory and psychotomimetic effects of smoked cannabis: naturalistic study”
(Αντίκτυπος της κανναβιδιόλης στην οξεία μνήμη και τις ψυχοτομυτικές επιδράσεις της με το κάπνισμα χορηγούμενης κάνναβης: φυσιολογική μελέτη)
Br J Psychiatry 197:285–290
* Morrison P., Zois V., McKeown D., Lee T., Holt D., Powell J., et al. (2009)
“The acute effects of synthetic intravenous delta9-tetrahydrocannabinol on psychosis, mood and cognitive functioning”
(Οι οξείες επιδράσεις της συνθετικής ενδοφλέβιας δέλτα-τετραϋδροκανναβινόλης στην ψύχωση, τη διάθεση και τη γνωστική λειτουργία)
Psychol Med 39:1607–1616
* Munro S., Thomas K., Abu-Shaar M. (1993)
“Molecular characterization of a peripheral receptor for cannabinoids”
(Μοριακός χαρακτηρισμός ενός περιφερειακού υποδοχέα για κανναβινοειδή)
Nature 365:61–65
* Navarro G., Carriba P., Gandia J., Ciruela F., Casadó V., Cortés A., et al. (2008)
“Detection of heteromers formed by cannabinoid CB2, dopamine D2, and adenosine A2A G-protein-coupled receptors by combining bimolecular fluorescence complementation and bioluminescence energy transfer”
(Ανίχνευση ετερομερών που σχηματίζονται από κανναβινοειδή CB2, ντοπαμίνη D2 και υποδοχείς συζευγμένους με πρωτεΐνη G2-αδενοσίνης Α2Α συνδυάζοντας τη συμπληρωματικότητα του διμοριακού φθορισμού και τη μεταφορά ενέργειας βιοφωταύγειας)
ScientificWorldJournal 8:1088–1097
* Nicholson A., Turner C., Stone B., Robson P. (2004)
“Effect of delta-9-tetrahydrocannabinol and cannabidiol on nocturnal sleep and early-morning behavior in young adults”
(Επίδραση της δέλτα-9-τετραϋδροκανναβινόλης και της κανναβιδιόλης στον νυκτερινό ύπνο και στη συμπεριφορά νωρίς το πρωί σε νεαρούς ενήλικες)
J Clin Psychopharmacol 24:305–313
* Nunes E., Liu X., Samet S., Matseoane K., Hasin D. (2006)
“Independent versus substance-induced major depressive disorder in substance-dependent patients: observational study of course during follow-up”
(Ανεξάρτητη έναντι από ουσία προκαλούμενη μείζονα καταθλιπτική διαταραχή σε εξαρτώμενους από την ουσία ασθενείς: παρατηρητική μελέτη κατά την παρακολούθηση)
J Clin Psychiatry 67:1561–1567
* Pagotto U., Marsicano G., Cota D., Lutz B., Pasquali R. (2006)
“The emerging role of the endocannabinoid system in endocrine regulation and energy balance”
(Ο αναδυόμενος ρόλος του ενδοκανναβινοειδούς συστήματος στην ενδοκρινική ρύθμιση και στην ενεργειακή ισορροπία)
Endocr Rev 27:73–100
* Pamplona F., Takahashi R. (2012)
“Psychopharmacology of the endocannabinoids: far beyond anandamide”
(Ψυχοφαρμακολογία των ενδοκανναβινοειδών: πολύ πέρα από το ανανδαμίδιο)
J Psychopharmacol 26:7–22
* Parker L., Rock E., Limebeer C. (2011)
“Regulation of nausea and vomiting by cannabinoids”
(Ρύθμιση της ναυτίας και του εμετού από τα κανναβινοειδή)
Br J Pharmacol 163:1411–1422
* Pertwee R. (1997)
“Pharmacology of cannabinoid CB1 and CB2 receptors”
(Φαρμακολογία των κανναβινοειδών CB1 και CB2 υποδοχέων)
Pharmacol Ther 74:129–180
* Pertwee R. (2006)
“The pharmacology of cannabinoid receptors and their ligands: an overview”
(Η φαρμακολογία των κανναβινοειδών υποδοχέων και των προσδεμάτων τους: μια επισκόπηση)
Int J Obes (Lond) 30:S13–S18
* Pertwee R. (2008)
“The diverse CB1 and CB2 receptor pharmacology of three plant cannabinoids: delta9-tetrahydrocannabinol, cannabidiol and delta9-tetrahydrocannabivarin”
(Η ποικίλη φαρμακολογία στους CB1 και CB2 υποδοχείς τριών φυτικών κανναβινοειδών: της δέλτα9-τετραϋδροκανναβινόλης, της κανναβιδιόλη και της δέλτα9-τετραϋδροκανναβιβαρίνης)
Br J Pharmacol 153:199–215
* Pertwee R. (2009)
“Emerging strategies for exploiting cannabinoid receptor agonists as medicines”
(Αναδυόμενες στρατηγικές για την εκμετάλλευση των αγωνιστών των υποδοχέων κανναβινοειδών ως φαρμάκων)
Br J Pharmacol 156:397–411
* Pertwee R. (2010)
“Receptors and channels targeted by synthetic cannabinoid receptor agonists and antagonists”
(Υποδοχείς και δίαυλοι που στοχεύονται από συνθετικούς αγωνιστές και ανταγωνιστές υποδοχέων κανναβινοειδών)
Curr Med Chem 17:1360–1381
* Pertwee R., Howlett A., Abood M., Alexander S., Di Marzo V., Elphick M. (2010)
“International Union of Basic and Clinical Pharmacology. LXXIX. Cannabinoid receptors and their ligands: beyond CB1 and CB2”
(Διεθνής Ένωση Βασικής και Κλινικής Φαρμακολογίας. LXXIX. Οι υποδοχείς κανναβινοειδών και οι συνδέτες τους: πέραν των CB1 και CB2)
Pharmacol Rev 62:588–631
* Peters B., de Koning P., Dingemans P., Becker H., Linszen D., de Haan L. (2009)
“Subjective effects of cannabis before the first psychotic episode”
(Οι υποκειμενικές επιδράσεις της κάνναβης πριν από το πρώτο ψυχωσικό επεισόδιο)
Aust N Z J Psychiatry 43:1155–1162
* Pickel V., Chan J., Kearn C., Mackie K. (2006)
“Targeting dopamine D2 and cannabinoid-1 (CB1) receptors in rat nucleus accumbens”
(Στόχευση υποδοχέων ντοπαμίνης D2 και κανναβινοειδούς-1 (CB1) σε nucleus accumbens αρουραίου)
J Comp Neurol 495:299–313
* Potter D., Clark P., Brown M. (2008)
“Potency of delta 9-THC and other cannabinoids in cannabis in England in 2005: implications for psychoactivity and pharmacology”
(Δραστικότητα της δέλτα-9-THC και άλλων κανναβινοειδών στην κάνναβη στην Αγγλία το 2005: επιπτώσεις στην ψυχοδραστικότητα και τη φαρμακολογία) J
Forensic Sci 53:90–94
* Raduner S., Majewska A., Chen J., Xie X., Hamon J., Faller B., et al. (2006)
“Alkylamides from Echinacea are a new class of cannabinomimetics. Cannabinoid type 2 receptor-dependent and -independent immunomodulatory effects”
(Οι αλκυλαμίδες από την Echinacea είναι μια νέα κατηγορία κανναβομιμητικών. Τύπου 2 κανναβινοειδούς υποδοχέα εξαρτώμενα και ανεξάρτητα ανοσορρυθμιστικά αποτελέσματα)
J Biol Chem 281:14192–14206
* Ramer R., Bublitz K., Freimuth N., Merkord J., Rohde H., Haustein M., et al. (2012)
“Cannabidiol inhibits lung cancer cell invasion and metastasis via intercellular adhesion molecule-1”
(Η κανναβιδιόλη αναστέλλει την εισβολή των κυττάρων του καρκίνου του πνεύμονα και τη μετάσταση μέσω του ενδοκυτταρικού μορίου προσκόλλησης-1)
FASEB J 26:1535-1548
* Rhee M., Vogel Z., Barg J., Bayewitch M., Levy R., Hanus L., et al. (1997)
“Cannabinol derivatives: binding to cannabinoid receptors and inhibition of adenylylcyclase”
(Παράγωγα κανναβιδιόλης: σύνδεση με υποδοχείς κανναβινοειδών και αναστολή της αδενυλυλκυκλάσης)
J Med Chem 40:3228–3233
* Russo E. B. (2001)
“Handbook of psychotropic herbs: a scientific analysis of herbal remedies for psychiatric conditions”
(Εγχειρίδιο ψυχοτρόπων βοτάνων: μια επιστημονική ανάλυση φυτικών θεραπειών για ψυχιατρικές καταστάσεις)
Binghamton, NY: Haworth Press
* Russo E., Guy G. (2006)
“A tale of two cannabinoids: the therapeutic rationale for combining tetrahydrocannabinol and cannabidiol”
(Μια ιστορία δύο κανναβινοειδών: το θεραπευτικό σκεπτικό για το συνδυασμό τετραϋδροκανναβινόλης και κανναβιδιόλης)
Med Hypotheses 66:234–246
* Russo E., Guy G., Robson P. (2007)
“Cannabis, pain, and sleep: lessons from therapeutic clinical trials of Sativex, a cannabis-based medicine”
(Η κάνναβη, ο πόνος και ο ύπνος: μαθήματα από θεραπευτικές κλινικές δοκιμές του Sativex, ενός φαρμάκου που βασίζεται στην κάνναβη)
Chem Biodivers 4:1729–1743
* Showalter V., Compton D., Martin B., Abood M. (1996)
“Evaluation of binding in a transfected cell line expressing a peripheral cannabinoid receptor (CB2): identification of cannabinoid receptor subtype selective ligands”
(Αξιολόγηση δέσμευσης σε διαμολυσμένη κυτταρική σειρά που εκφράζει έναν περιφερειακό υποδοχέα κανναβινοειδών (CB2): ταυτοποίηση επιλεκτικών υποκαταστατών υποδοχέα κανναβινοειδούς υποδοχέα)
J Pharmacol Exp Ther 278:989–999
* Smieskova R., Fusar-Poli P., Allen P., Bendfeldt K., Stieglitz R., Drewe J., et al. (2010)
“Neuroimaging predictors of transition to psychosis – a systematic review and meta-analysis”
(Νευροαπεικόνιση των προγνωστικών της μετάβασης στην ψύχωση – μια συστηματική ανασκόπηση και μετα-ανάλυση)
Neurosci Biobehav Rev 34:1207–1222
* Stirling J., Barkus E., Nabosi L., Irshad S., Roemer G., Schreudergoidheijt B., et al. (2008)
“Cannabis-induced psychotic-like experiences are predicted by high schizotypy. Confirmation of preliminary results in a large cohort”
(Οι επαγόμενες από την κάνναβη ψυχωσικές εμπειρίες προβλέπονται από τον υψηλό σχιζότυπο. Επιβεβαίωση προκαταρκτικών αποτελεσμάτων σε μεγάλη ομάδα)
Psychopathology 41:371–378
* Stone J. (2011)
“Glutamatergic antipsychotic drugs: a new dawn in the treatment of schizophrenia?”
(Γλουταματερικά αντιψυχωσικά φάρμακα: μια νέα αυγή στη θεραπεία της σχιζοφρένειας;)
Ther Adv Psychopharmacol 1:5–18
* Taylor A., Amoako A., Bambang K., Karasu T., Gebeh A., Lam P., et al. (2010)
“Endocannabinoids and pregnancy”
(Ενδοκανναβινοειδή και εγκυμοσύνη)
Clin Chim Acta 411:921–930
* Terry G., Liow J., Zoghbi S., Hirvonen J., Farris A., Lerner A. (2009)
“Quantitation of cannabinoid CB1 receptors in healthy human brain using positron emission tomography and an inverse agonist radioligand”
(Ποσοτικοποίηση των κανναβινοειδών υποδοχέων CB1 σε υγιή ανθρώπινο εγκέφαλο χρησιμοποιώντας τομογραφία εκπομπής ποζιτρονίων και ένα αντίστροφο αγωνιστή ραδιοσυνδέτη)
Neuroimage 48:362–370
* Thomas H. (1996)
“A community survey of adverse effects of cannabis use”
(Μια κοινοτική έρευνα σχετικά με τις δυσμενείς επιδράσεις της χρήσης κάνναβης)
Drug Alcohol Depend 42:201–207
* Torres S., Lorente M., Rodriguez-Fornés F., Hernandez-Tiedra S., Salazar M., Garcia-Taboada E., et al. (2011)
“A combined preclinical therapy of cannabinoids and temozolomide against glioma”
(Μια συνδυασμένη προκλινική θεραπεία των κανναβινοειδών και της τεμοζολομίδης κατά του γλοιώματος)
Mol Cancer Ther 10:90–103
* Tsou K., Brown S., Sanudo-Pena M., Mackie K., Walker J. (1998)
“Immunohistochemical distribution of cannabinoid CB1 receptors in the rat central nervous system”
(Ανοσοϊστοχημική κατανομή κανναβινοειδών CB1 υποδοχέων στο κεντρικό νευρικό σύστημα αρουραίου)
Neuroscience 83:393–411
* van Os J., Bak M., Bijl R., De Graaf R., Verdoux H. (2002)
“Cannabis use and psychosis: a longitudinal population-based study”
(Χρήση κάνναβης και ψύχωση: μια διαχρονική πληθυσμιακή μελέτη)
Am J Epidemiol 156:319–327
* van Os J., Kapur S. (2009)
“Schizophrenia”
(Σχιζοφρένεια)
Lancet 374:635–645
* van Waes V., Beverley J., Siman H., Tseng K., Steiner H. (2012)
“CB1 cannabinoid receptor expression in the striatum: association with corticostriatal circuits and developmental regulation”
(CB1 έκφραση υποδοχέα κανναβινοειδούς στο ραβδωτό σώμα: συσχέτιση με κυτταροκοινωνικά κυκλώματα και αναπτυξιακή ρύθμιση)
Front Pharmacol 3:21
* van Winkel R., Genetic Risk and Outcome of Psychosis (GROUP) Investigators (2011)
“Family-based analysis of genetic variation underlying psychosis-inducing effects of cannabis: sibling analysis and proband follow-up”
(Οικογενειακή ανάλυση των γενετικών παραλλαγών που υποδηλώνουν τις συνέπειες της κάνναβης που προκαλούν ψύχωση: ανάλυση των αδελφών και παρακολούθηση των πρώτων μελών οικογένειας)
Arch Gen Psychiatry 68:148–157
* Wallace M., Wiley J., Martin B., DeLorenzo R. (2001)
“Assessment of the role of CB1 receptors in cannabinoid anticonvulsant effects”
(Αξιολόγηση του ρόλου των υποδοχέων CB1 σε κανναβινοειδή αντισπασμωδικά αποτελέσματα)
Eur J Pharmacol 428:51–57
* Winton-Brown T., Allen P., Bhattacharrya S., Borgwardt S., Fusar-Poli P., Crippa J., et al. (2011)
“Modulation of auditory and visual processing by delta-9-tetrahydrocannabinol and cannabidiol: an fMRI study”
(Διαμόρφωση ακουστικής και οπτικής επεξεργασίας με δέλτα-9-τετραϋδροκανναβινόλη και κανναβιδιόλη: μελέτη fMRI)
Neuropsychopharmacology 36:1340–1348
* Wood T. (1899)
“Cannabinol, part I”
(Κανναβινόλη, μέρος Ι)
J Chem Soc 75:20–36
* Zammit S., Allebeck P., Andreasson S., Lundberg I., Lewis G. (2002)
“Self reported cannabis use as a risk factor for schizophrenia in Swedish conscripts of 1969: historical cohort study”
(Η αυτοαναφερόμενη χρήση κάνναβης αποτελεί παράγοντα κινδύνου για σχιζοφρένεια σε Σουηδούς στρατιώτες του 1969: ιστορική μελέτη κοόρτης)
BMJ 325:1199–1201
* Zammit S., Spurlock G., Williams H., Norton N., Williams N., O’Donovan M., et al. (2007)
“Genotype effects of CHRNA7, CNR1 and COMT in schizophrenia: interactions with tobacco and cannabis use”
(Γενοτυπικές επιδράσεις των CHRNA7, CNR1 και COMT στη σχιζοφρένεια: αλληλεπιδράσεις με τη χρήση καπνού και κάνναβης)
Br J Psychiatry 191:402–407
* Zuardi A., Guimaraes F. (1997)
“Cannabidiol as an anxiolytic and antipsychotic. In: Mathre M., editor. (ed), Cannabis in Medical Practice: A Legal, Historical and Pharmacological Overview of the Therapeutic Use of Marijuana”
(Η κανναβιδιόλη ως αγχολυτικό και αντιψυχωτικό. από: Mathre M., συντάκτης. (ed), Η κάνναβη στην ιατρική πρακτική: Μια νομική, ιστορική και φαρμακολογική επισκόπηση της θεραπευτικής χρήσης της κάνναβης)
Jefferson, NC: McFarland, p.133–141
* Zuardi A., Morais S., Guimaraes F., Mechoulam R. (1995)
“Antipsychotic effect of cannabidiol [letter]”
(Αντιψυχωσικό αποτέλεσμα της κανναβιδιόλης [επιστολή])
J Clin Psychiatry 56:485–486











